Recomendações aos alunos.
* Leiam o texto com atenção.* Assistam às aulas pelo CMSP, TV, vídeo aulas pela plataforma Stoodi.
* Identifiquem as atividades com o nome, série e n° de chamada ( se possível ), título da atividade e data de postagem no Blog.
* As atividades deverão ser enviadas para o e-mail: josecorreia@prof.educacao.sp.gov.br
Olá pessoal! Que todos estejam bem.
Calor é a energia térmica que passa de um corpo mais quente para outro mais frio.
Como calor é uma forma de energia, sua unidade de medida é joule (J). Porém no cotidiano é muito comum o uso da caloria (cal) como unidade de medida do calor.
Relação entre caloria e joule:
1 cal = 4,186 J
A quilocaloria (Kcal) é um múltiplo da caloria e corresponde a 1 Kcal = 1000 cal
Para conversão de caloria em joule, basta montar uma regra de três. Veja:
Adote 1 cal = 4,2 J e converta:
a) 240 cal em joule. b) 840 J em cal. c) 2 Kcal em joule.
Resolução: Resolução: Resolução:
1 cal - 4,2 J 1 cal - 4,2 J 1 cal - 4,2 J
240 cal - x J x cal - 840 J 2000 cal - x J
1 . x = 240 . 4,2 x . 4,2 = 840 . 1 x = 2000 . 4,2
x = 1008 J x = 840/4,2 x = 8400 J
x = 200 cal.
Não se esqueçam que a unidade de medida oficial de calor é o joule e a caloria não é oficial.

Resolução:
1°) Observe que ocorre apenas mudança de estado físico, portanto o calor é latente.
Q = m . Lf
Q = 200 . 80
Q = 16000cal.
2°) A água proveniente do derretimento do gelo está à 0°C, e será aquecida até 20°C. Portanto o calor é sensível.
Q = m . c . (Θf - Θi)
Q = 200 . 1 . (20 - 0)
Q = 200 . 20
Q = 4000cal
3°) Agora vamos somar as quantidades de calor.
Qt = Q1 + Q2
Qt = 16000 + 4000
Qt = 20000cal ou 20Kcal.
2) Um bloco de gelo de 500g está à -5°C. Determine a quantidade de calor necessária para transformar-lo totalmente em vapor de água à 100°C. Dados: calor específico da água c = 1cal/g.°C e calor específico do gelo c = 0,5cal/g.°C, Lf = 80cal/g, Lv = 540cal/g.
Resolução:
Esse exercícios será dividido em quatro etapas:
1ª) Aquecimento do gelo de -5°C até 0°C ( calor sensível)
Q = m . c . (Θf - Θi)
Q = 500 . 0,5 . (0 - (-5))
Q = 250 . 5
Q = 1250cal
2ª) Fusão do gelo (calor latente)
Q = m .Lf
Q = 500 . 80
Q = 40000cal
3ª) Aquecimento da água de 0°C à 100°C (calor sensível)
Q = m . c . (Θf - Θi)
Q = 500 . 1 . (100 - 0)
Q = 500 . 100
Q = 50000cal
4ª) Vaporização da água (calor latente)
Q = m . Lv
Q = 500 . 540
Q = 270000cal
Agora vamos somar as quantidades de calor de cada etapa.
Qt = Q1 + Q2 + Q3 + Q4
Qt = 1250 + 40000 + 50000 + 270000
Qt = 361250cal ou 361,25Kcal
O gráfico acima é chamado de curva de aquecimento. Os patamares do gráfico ( S + L) e ( L + G), indicam mudança de estado físico ( calor latente) e nas linhas crescentes, onde ocorre variação de temperatura, calor sensível.
3) Dado o diagrama de aquecimento de um material:

a) Porque o piso de cerâmica está mais quente que o piso de madeira, por isso a sensação de mais frio no piso de cerâmica.
b) Porque o piso de cerâmica está mais frio que o piso de madeira, por isso a sensação de mais frio no piso de cerâmica.
c) Porque o piso de madeira troca menos calor com os nossos pés, causando-nos menos sensação de frio.
d) Porque o piso de cerâmica troca menos calor com os pés, causando-nos mais sensação de frio.
e) Porque o piso de cerâmica tem maior área de contato com os pés, causando-nos uma maior sensação de frio.
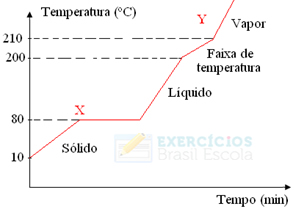
2) Uma amostra de uma substância encontra-se, inicialmente, no estado sólido na temperatura T0 Passa, então, a receber calor até atingir a temperatura fInaI Tf, quando toda a amostra já se transformou em vapor. O gráfico abaixo representa a variação da temperatura T da amostra em função da quantidade de calor Q por ela recebida.

Considere as seguintes afirmações, referentes ao gráfico.
I. T1 e T2 são, respectivamente, as temperaturas de fusão e de vaporização da substância.
II. No intervalo X, coexistem os estados sólido e líquido da substância.
III. No intervalo Y, coexistem os estados sólido, líquido e gasoso da substância.
Quais estão corretas?
a) apenas I
b) apenas II
c) apenas III
d) apenas I e II
e) I, II e III
3) O calor específico da água é da ordem de 1,0 cal/g .°C e seu calor latente de fusão é igual a 80 cal/g. Para transformar 200 g de gelo a 0°C em água a 30°C, a quantidade de energia necessária, em quilocalorias, equivale a:
a) 22 Kcal
b) 18 Kcal
c) 16 Kcal
d) 12 Kcal
e) 10 Kcal
4) Uma massa de água de 300 g recebeu 6000 cal. Se a temperatura da água era de 20°C, determine a temperatura atingida pela massa de água após o recebimento do calor.
Dados: calor específico da água c = 1 cal/g.°C
a) 60°C
b) 55°C
c) 50°C
d) 45°C
e) 40°C
5) O gráfico abaixo representa o aquecimento de 50 g de uma substância que se encontra inicialmente no estado líquido.
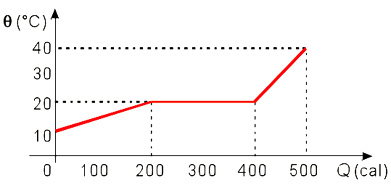
Podemos afirmar que que o calor específico da substância no estado líquido é:
a) 0,2 cal/g.°C
b) 0,4 cal/g.°C
c) 0,5 cal/g.°C
d) 0,6 cal/g.°C
e) 0,8 cal/g.°C
Nenhum comentário:
Postar um comentário
Não esqueça de colocar seu nome completo e série/ano turma