Recomendações aos alunos:
* Leiam com atenção e observem os exemplos.
* Assistam às vídeo aulas pelo CMSP, TV, plataforma Stoodi.
* Façam pesquisas em livros didáticos ou pela internet.
* Identifiquem as atividades com a data de postagem, nome, série, turma e nº de chamada (se possível).
* Enviem as atividades para o E-mail: josecorreia@prof.educacao.sp.gov.br
* Data de entrega: até 20/10.
Olá pessoal! Que todos estejam bem.
Nessa semana de estudos intensivos vamos revisar a Física nuclear e radiação.
A Física nuclear estuda o núcleo atômico, suas partículas, e a energia nuclear. A radiação estuda as emissões radioativas alfa, beta e gama, os radioisótopos e sua utilização e o tempo de meia-vida dos isótopos radioativos.
A Física Nuclear estuda os fenômenos físicos relativos aos núcleos atômicos, como transições de energia, decaimentos radioativos, fissão e fusão nuclear, entre outros. O estudo da Física Nuclear envolve o desenvolvimento de modelos que expliquem o funcionamento dos núcleos atômicos e sua constituição, aplicações da energia nuclear em tratamentos médicos, desenvolvimento de tecnologias para a detecção de radiação, novas fontes de energia, etc.

A fissão nuclear é uma reação em cadeia que ocorre quando um núcleo atômico pesado captura um nêutron lento.
As aplicações tecnológicas diretamente relacionadas ao estudo da Física Nuclear estão relacionadas a processos industriais, eficiência energética, explorações astronômicas, etc. Além disso, esse estudo promove melhorias à saúde, meio ambiente e agricultura.
Física Nuclear na saúde
Nos últimos anos, a Física Nuclear tem possibilitado, por meio da medicina nuclear, o surgimento de tecnologias de grande impacto à saúde humana. Um crescente número de exames de imagem tem sido realizado com uso de diferentes tipos de radiação e partículas. Além disso, um enorme número de pacientes recebe tratamento oncológico por meio da radiação produzida por aceleradores de partículas ou fontes naturais de radiação, como os radioisótopos césio-137, iodo-131, entre outros encontrados na natureza. Atualmente, existem tratamentos de câncer avançados, com menos efeitos colaterais, que são capazes de destruir os tecidos afetados pelo câncer por meio da emissão de prótons, nêutrons, íons pesados e radiação eletromagnética ionizante.
Veja também: O uso de radiação em alimentos
Alguns exames de imagem baseiam-se em conhecimentos originados de pesquisas desenvolvidas pela Física Nuclear, como tomografias computadorizadas, ressonâncias magnéticas nucleares, tomografias por emissão de pósitrons, tomografias computadorizadas de emissão de fótons simples. Esses exames fornecem imagens ricamente detalhadas de órgãos e estruturas delicados sem que haja necessidade de intervenções cirúrgicas e com segurança relativamente alta aos pacientes.
Veja também: Conheça o projeto sirius
Física Nuclear e meio ambiente
A Física Nuclear também é largamente aplicada aos estudos do meio ambiente: a datação dos núcleos radioativos presentes nas rochas e no solo, por exemplo, é de importância vital para a determinação do passado da Terra e para a definição de padrões climáticos.
Veja também: A estrutura do átomo e a radioatividade
A atmosfera terrestre é constantemente bombardeada por raios cósmicos altamente energéticos, cujas interações com as moléculas de carbono presentes no ar produzem o isótopo carbono-14. Esse elemento raro tem uma meia vida extremamente longa: a cada 5700 anos, o número desse tipo de radioisótopo presente em seres vivos, como plantas e animais, cai pela metade. Dessa forma, é possível estudar a idade de fósseis e, até mesmo, determinar a época em que grandes florestas ou ecossistemas inteiros deixaram de viver.
Física Nuclear e indústria
Muitas técnicas derivadas da Física Nuclear, mais explicitamente de aceleradores de partículas, passaram a ser usadas em processos industriais, promovendo aumento de sua eficiência e grande impacto econômico.

Os aceleradores de partículas podem ser usados para produzir radiação eletromagnética altamente energética.
Uma das aplicações mais importantes para a indústria são os detectores utilizados na determinação da composição de materiais semicondutores. Os semicondutores figuram como a matéria-prima de todos os componentes eletrônicos usados, desde chips presentes nos computadores e celulares até simples conexões elétricas. Para que esses componentes funcionem perfeitamente, é de fundamental importância que sua pureza seja garantida. Dessa forma, técnicas de caracterização de elementos químicos, como a PIXE (emissão de raios X induzida por partículas), medem a emissão de raios X de amostras bombardeadas por prótons durante a colisão do feixe de prótons com os núcleos atômicos. Essas técnicas medem também a emissão de ondas eletromagnéticas para determinar características, como massa atômica e carga elétrica, de algum material.
Veja também: Radiações alfa, beta e gama
A técnica PIXE e outras técnicas, como a PIGE (emissão de raios gamas induzida por prótons), são capazes de determinar a exata composição de diversos tipos de amostras. São também utilizadas em museus para determinar-se a originalidade de uma obra e em sondas espaciais, como a Mars Rover, que tem o intuito estudar a composição do planeta Marte.
Produção de energia elétrica
Atualmente, cerca de 11% de toda a energia elétrica produzida no mundo vem de aproximadamente 450 reatores nucleares. Toda energia nuclear é gerada a partir da fissão de núcleos atômicos pesados, como o urânio, que se tornam instáveis após a captura de um nêutron lento emitido em sua direção.

O urânio é encontrado na natureza em forma de minério. Acima, há a imagem de uma autunita, um mineral radioativo que contém urânio.
Desde 2016, existem cerca de 60 reatores nucleares em construção em todo o mundo e outros 150 planejados. Quando implementadas, essas usinas nucleares serão responsáveis por 50% da geração mundial de energia.
Dezesseis países dependem da energia nuclear para produzir pelo menos 25% de toda sua demanda energética. A França, por exemplo, tem 75% de toda sua energia produzida por usinas nucleares em decorrência da escassez de recursos energéticos naturais, como potencial hídrico, eólico, geotérmico, etc.

O baixo custo e a alta produção energética são alguns pontos fortes da energia nuclear.
O curso de Física Nuclear
Para estudar a fundo sobre Física Nuclear, normalmente, é necessário graduar-se em Física para, em seguida, especializar-se com um mestrado ou doutorado na área. No entanto, durante o curso de graduação, estudam-se fenômenos de origem nuclear nos conteúdos regulares (isso pode variar de acordo com a ementa de cada curso). Além disso, é possível aprender sobre Física Nuclear por meio de pesquisas realizadas em programas de iniciação científica.
Os conteúdos relacionados à Física Nuclear mais comuns nos cursos de Física tratam sobre modelos nucleares modernos, transições de níveis de energia de núcleos atômicos, emissão de radiação, decaimentos radioativos, etc.
Fórmulas utilizadas pela Física Nuclear
Confira algumas das principais fórmulas usadas no estudo da Física Nuclear e suas utilizações:
Fórmula | Para que serve? |
Defeito de massa | Calcula a diferença entre a massa presente em vários prótons e nêutrons separados e a massa dessas partículas combinadas: parte da massa total converte-se em energia de ligação. |
Energia de repouso | Equação de Albert Einstein que relaciona a diferença de massa com a energia liberada durante a fissão nuclear de um elemento. |
Decaimento radioativo | Relaciona a quantidade de isótopos radioativos presentes em uma determinada porção de matéria. Pode ser utilizada para calcular a idade de uma amostra. |
Emissão Alfa | Relaciona, por meio da conservação da energia, os números atômicos e de massa de elementos radioativos antes e após a emissão de um núcleo de hélio durante a emissão alfa. |
Emissão Beta | Relaciona os números atômico e de massa de um elemento que emita uma partícula (beta) por meio da conservação da energia. |
Emissão Gama | Representa a conservação de energia durante o processo de emissão da radiação gama. |
História da Física Nuclear
A história da Física Nuclear começou no final do século XIX e vem sendo construída até os dias recentes. Confira uma breve linha do tempo com alguns dos marcos mais importantes da Física Nuclear:
1896 – Henri Becquerel, um físico francês, descobriu que sais de urânio são capazes de manchar placas fotossensíveis, descobrindo, assim, os “raios urânicos”.
1897 – Ernest Rutherford fez pesquisas sobre os “raios urânicos” de Becquerel e descobriu as radiações alfa e beta, classificando-as quanto às suas cargas elétricas e ao seu poder de penetração na matéria.
1898 – Marie Currie e seu esposo, Pierre Currie, descobriram que os “raios urânicos” também são emitidos por outros elementos (tório) e propuseram o termo “radioatividade”. Descobriram e batizaram dois novos elementos radioativos: polônio e rádio.
1903 – Ernest Rutherford propôs a medição da idade geológica da Terra por meio da detecção de elementos radioativos em seu interior. Além disso, sugeriu que a Terra é muito mais antiga do que se acreditava. Alguns anos depois, descobriu-se que a Terra tem cerca de 4,2 bilhões de anos. Na época, acreditava-se em algumas centenas de milhões de anos.
1906 – Ernest Rutherford descobriu que a radiação alfa é, na verdade, o núcleo de um átomo de hélio.
1909 – Os estudantes de graduação Eugene Mardsen e Hans Geiger realizaram o experimento da folha de ouro, no qual uma fina película aurífera é bombardeada por partículas alfa, que são refletidas, indicando a grande densidade do núcleo atômico.
1930 – Paul Dirac reuniu os campos da relatividade especial de Albert Eistein à teoria quântica e elaborou a equação de Dirac, prevendo, assim, a existência da antimatéria.
1931 – Físicos debateram possibilidades para a não conservação da energia durante os decaimentos beta. Nessa época, o físico italiano Enrico Fermi propôs que, nesse tipo de decaimento, ocorria a emissão de duas partículas neutras praticamente indetectáveis, as quais ele batizou de neutrinos.
1932 – Carl Anderson detectou a existência dos pósitrons, partículas com carga elétrica oposta e massa igual à dos elétrons.
1935 – O físico japonês Hideki Yukawa propôs que os prótons e nêutrons presentes no núcleo dos átomos são ligados por uma força nuclear forte, muito mais intensa que a própria repulsão elétrica.
1938 – Otto Hahn e Lise Meitner descobriram a fissão nuclear ao bombardearem núcleos de urânio com nêutrons.
1942 – Enrico Fermi foi nomeado o principal cientista responsável pelo projeto Manhattan, intencionado em produzir a primeira reação nuclear artificial em cadeia.
1945 – Em 16 de julho, a primeira bomba nuclear foi detonada no Novo México. Três meses depois, duas bombas atômicas foram lançadas nas cidades de Hiroshima e Nagasaki, no Japão, deixando mais de 100 mil mortos.
Física Nuclear no Brasil
Um dos precursores da pesquisa científica na área da Física no Brasil foi o físico ucraniano Gleb Wataghin. Wataghin ingressou na USP em 1934, onde iniciou suas pesquisas sobre raios cósmicos e sobre Física Nuclear. Na época, investia-se pouco nesse tipo de pesquisa, então, os primeiros instrumentos necessários para o estudo da Física Nuclear foram construídos pelos alunos da primeira turma de Física daquela universidade: Marcelo Damy e Oscar Sala. A partir dessa época, a pesquisa em Física Nuclear no Brasil cresceu até atingir visibilidade internacional.
Tipos de partículas subatômicas
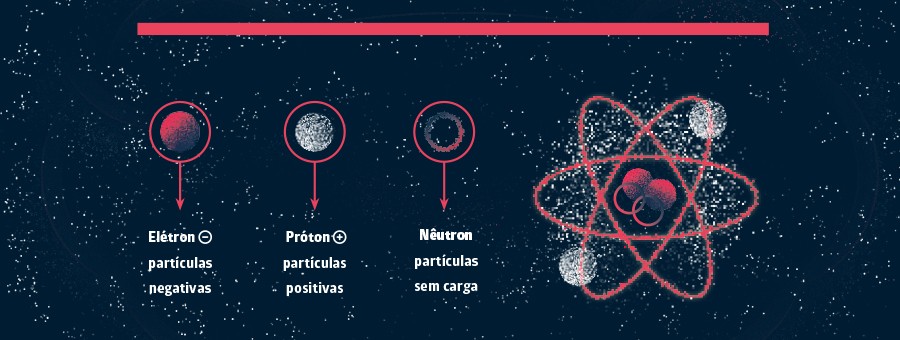
Fonte: Revista Galileu
Além dos nêutrons, elétrons e prótons, que são as partículas subatômicas mais conhecidas, existem outros tipos de elementos com as mesmas condições.
Veja abaixo as 7 partículas subatômicas mais importantes:
Neutrino
Neutrino é uma partícula subatômica neutra, sem carga elétrica. Ou seja, que não interagem com as demais partículas da natureza. Depois dos fótons, por exemplo, o neutrino é considerado a partícula elementar mais presente em todo o Universo.
Tal partícula se divide em três variedades, ou seja, o neutrino do elétron, o neutrino do múon e o neutrino do tau. Nesse sentido, é importante destacar que cada partícula lépton possui uma antipartícula, neste caso, um antineutrino.
Elétron
Os elétrons, aliás, foram as primeiras partículas subatômicas descobertas. Eles são parte da constituição de um átomo e se localizam em movimento ao redor do núcleo, nas camadas eletrônicas.
Quarks
Tratam-se de partículas elementares e um dos dois elementos básicos que constituem a matéria. Os Quarks formam partículas compostas, denominadas de hádrons, que estão sempre associados uns aos outros. São divididos em seis tipos:
- Up – com carga de + 2/3
- Down – com carga de – 1/3 constituem os prótons e os nêutrons
- Charm – com carga de + 2/3
- Strange – com carga de – 1/3
- Bottom – com carga de – 1/3
- Top – com carga de + 2/3, é aproximadamente 200 vezes mais pesado que um próton
Glúon
Essas partículas fundamentais agem como partículas de troca, fazendo uma força forte entre os quarks. São responsáveis por levar a carga de cor da interação forte, ou seja, interação entre quarks e glúons.
Bósons da força fraca
São formados pelos componentes W-, W+ e Z, os quais possuem mais de 86 vezes o peso de um próton inteiro. Inclusive, no início do Universo, foram associados a outras partículas, que juntas formavam a eletrofraca.
Fóton
São conhecidos como as partículas que formam a luz visível. A sua força eletromagnética é a principal responsável por manter os elétrons em torno do núcleo. Nesse sentido, é ela que determina as ligações químicas dos átomos e moléculas.
Gráviton
Em síntese, trata-se de uma partícula elementar hipotética, responsável pela transmissão da força da gravidade na maioria dos modelos da teoria quântica. É considerada hipotética por não ser, ainda, compreendida pela física quântica.
E ai, gostou dessa matéria? Se sim, confira mais sobre Quarks, constituintes elementares dos prótons e neutrôns.
Radioatividade é um fenômeno nuclear que resulta da emissão de energia por átomos, provocada em decorrência de uma desintegração, ou instabilidade, de elementos químicos.
Uma reação nuclear é diferente de uma reação química. Em transformações nucleares o núcleo do átomo sofre alterações, já as reações químicas ocorrem na eletrosfera do átomo.
Desta forma, um átomo pode se transformar em outro átomo e, quando isso acontece, significa que ele é radioativo.
Tipos de Radioatividade
A radioatividade das partículas Alfa, Beta e das ondas Gama são as mais comuns. O tipo de radiação determina o poder de penetração na matéria, que são, respectivamente, baixa, média e alta.
Emissões Alfa ( ₂He⁴):
São partículas pesadas de carga positiva, que possuem carga elétrica +2 e massa igual a 4.

Por possuir 2 prótons e 2 nêutrons, seu núcleo é comparado ao do elemento químico hélio, e por isso, alguns autores também a chamam de “hélion”.
Possui pequeno poder de penetração, e por isso a sua radioatividade pode ser impedida por uma folha de papel.
Emissões Beta (-₁e⁰):
São partículas leves, de carga negativa e que não contêm massa. O elétron da partícula é produzido por reações nucleares a partir de um nêutron e possui alta velocidade.

Nessa reação, um nêutron instável se desintegra, convertendo-se em um próton, que permanece no núcleo, há a emissão de um elétron em alta velocidade e do neutrino, cuja massa e carga são desprezíveis.
Possui poder de penetração superior a radioatividade alfa, podendo penetrar uma folha de papel, mas não uma placa de metal.
Emissões Gama (₀γ⁰):
São ondas eletromagnéticas de altíssima frequência e que não possuem massa e carga elétrica.

A sua capacidade de penetração é superior aos raios-X e faz com que a sua radioatividade passe tanto pelo papel como pelo metal.
Como podemos ver a seguir, as radiações diferem no poder de penetração.

A radiação gama é bem mais penetrante que os outros dois tipos devido o seu comprimento de onda ser bem menor, podendo facilmente atravessar todo o nosso organismo.
Resumimos as características das emissões radioativas da seguinte forma:
| Nome | Símbolo | Carga elétrica | Natureza | Poder de penetração |
|---|---|---|---|---|
| Alfa | α | positiva | Formada por dois prótons e dois nêutrons. | pequeno |
| Beta | β | negativa | Elétron produzido em transformações nucleares. | médio |
| Gama | Υ | 0 | Radiação eletromagnética. | alto |
À medida que a radiação é emitida, o átomo se desintegra, o que resulta na sua transformação, pois é o número atômico que determina o elemento químico.
O tempo que essa desintegração do elemento leva para reduzir a sua massa pela metade é chamado de meia-vida ou período de semi desintegração.
Leis da Radioatividade
Os estudos sobre as emissões radioativas contribuíram para criação de duas leis sobre as desintegrações que ocorrem em núcleos atômicos.
Em 1911, Frederick Soddy formulou a Primeira Lei da Radioatividade, a respeito das emissões alfa, que se tornou conhecida como Lei de Soddy:
Um átomo instável emite uma partícula alfa (α), diminui o número atômico (Z) em duas unidades, ao passo que o número de massa (A) diminui em quatro unidades. Assim: 24α
Segundo essa lei, um novo elemento químico pode ser formado com número atômico com duas unidades a menos que o elemento inicial.
Elementos Radioativos
A radioatividade pode ser natural, encontrada em elementos que estão dispostos na natureza ou artificial, pela criação de elementos radioativos em laboratório.
- Elementos Radioativos Naturais: as famílias radioativas naturais são encontradas na natureza, donde os elementos radioativos são transformados por meio de desintegrações, até chegarem num elemento químico estável, por exemplo, o urânio, o actínio e o tório.
- Elementos Radioativos Artificiais: obtidos artificialmente nas reações artificiais de transmutação, a qual produz um novo elemento químico radioativo, por exemplo: iodo-131 e o fósforo-30.
Decaimento radioativo
À medida que a radiação é emitida, o átomo se desintegra, o que resulta na sua transformação, pois é o número atômico que determina o elemento químico.

No decaimento radioativo há a diminuição da atividade radioativa e o tempo que essa desintegração do elemento leva para reduzir a sua massa pela metade é chamado de meia vida ou período de semi desintegração.
Descoberta da radioatividade
A radioatividade foi descoberta em 1896 por Henri Becquerel, ao investigar a fosforescência natural das substâncias.
O casal Pierre e Marie Curie dedicou-se ao estudo das emissões radioativas e constatou que essa era uma propriedade de determinados elementos químicos. Inclusive, durante essas pesquisas descobriram dois novos elementos radioativos: rádio e polônio.
Em 1898 Ernest Rutherford descobriu as emissões radioativas alfa e beta. Um terceiro tipo de radioatividade, a emissão gama, foi descoberta em 1900, pelo químico e físico francês Paul Ulrich Villard.
Unidades de medida de radiação.
A unidade de Atividade é o Curie (Ci). Originalmente foi definido como a quantidade de material radioativo que se desintegra com a mesma velocidade que um grama de rádio puro. Posteriormente foi definido mais rigorosamente como a quantidade de material radioativo em que se desintegram 3,7 x 1010 átomos por segundo.
A unidade de Atividade no Sistema Internacional (SI) é o bequerel (Bq). É a quantidade de material radiativo em que um átomo se transforma por segundo.
1 Ci = 3,7.10¹° Bq
Atividade específica é a relação entre a massa de material radioativo e a Atividade. Exprime-se pelo número de Ci ou Bq por unidade de massa ou de volume.
Utilização da radioatividade
A radioatividade tem muitas aplicações na sociedade. Desde a sua descoberta, grandes avanços científicos foram alcançados gerando desenvolvimento tecnológico.
A emissão de radiação tem utilizações em diferentes setores como na medicina, geologia, indústria e armamento.
Radioatividade na medicina
A radioatividade na medicina é utilizada através dos exames de raio-x, cuja radiação atravessa os tecidos com o objetivo de mostrar internamente o corpo humano.
Outra aplicação é na radioterapia para o tratamento do câncer com emissão de radiação. Como as células cancerígenas são mais sensíveis à radiação é possível destruí-las com dosagens controladas sem afetar as células normais.

Os radioisótopos também podem ser utilizados no diagnóstico de doenças, tratamento de tumores e como marcadores para informar o estado de saúde dos órgãos.
Datação por Carbono-14
Na natureza existe três isótopos do carbono:
| Carbono-12 | ₆C¹² | abundância de 98,9% |
| Carbono-13 | ₆C¹³ | abundância de 1,1% |
| Carbono-14 | ₆C¹⁴ | abundância de 0,000001% |
O menos abundante deles, o carbono-14, por ser radioativo, é utilizado para determinar a idade de objetos antigos.
O teor de carbono-14 é de 10 ppb e na atmosfera ele é incorporado na forma de CO2.
Sendo assim, seres fotossintetizantes absorvem esse radioisótopo e ele é transferido para os demais seres vivos pelas cadeias alimentares.
Com a mesma velocidade que o carbono-14 se forma, ele se desintegra por meio de decaimento beta.

Ao observar múmias e fósseis é possível perceber que o teor de carbono é inferior a 10 ppb, e como seu tempo de meia-vida é de 5730 anos, com esses dados é possível determinar a idade do ser encontrado.
Usina nuclear
Nesse sistema, as reações nucleares são manipuladas de forma controlada para a produção de energia na forma de calor.
O calor produzido é utilizado no aquecimento de água, e o vapor gerado movimenta turbinas geradoras de eletricidade.
Devido o crescimento populacional e a busca para diversificação da matriz energética, hoje a energia nuclear é responsável por 17% da geração de energia elétrica no mundo.

O Brasil, apesar de possuir enorme potencial hidrelétrico, também produz energia elétrica a partir da energia nuclear através das usinas nucleares Angra 1 e Angra 2.
A poluição radioativa é um dos problemas do uso da radioatividade.
Os resíduos dos materiais compostos por elementos radioativos representam um grande risco à população, uma vez que podem provocar doenças, tal como o câncer.

Diversas áreas (medicina, engenharia, antropologia, entre tantas outras) fazem uso de materiais que contém radioatividade.
Assim, os cuidados com os resíduos são indispensáveis para que esse tipo de lixo não contamine o ambiente ou, ainda, resulte em acidentes nucleares.
É o caso do conhecido Acidente de Chernobyl ocorrido em 1986 na Ucrânia. No nosso país, o Acidente Césio-137 aconteceu no ano seguinte, em 1987, em Goiânia, e foi provocado por um aparelho de radioterapia abandonado.
O Trifólio é o símbolo de radioatividade. O núcleo radioativo é representado pelo círculo central, e as radiações alfa, beta e gama, são representadas pelas três pás em torno do círculo central.
A radiação pode ser ionizante ou não ionizante.
Radiação ionizante possui alta frequência, e portanto alta energia, sendo capaz de retirar elétrons do átomo, provocando a ionização. A radiação ionizante provoca alterações nas células dos tecidos, provocando doenças, como o câncer.
Radiação não ionizante possui baixa frequência, e portanto baixa energia, não provocando a ionização dos átomos, portando não causa problemas de saúde.
Radioisótopos é o nome dado aos isótopos radioativos, como, por exemplo, o urânio e o hidrogênio.
Isótopos são átomos com o mesmo número atômico e diferente número de massa, mas como saber se são radioativos?
Conheça alguns:
Isótopos do Hidrogênio:
.jpg)
Observe que os isótopos do elemento Hidrogênio possuem o mesmo número atômico (1), mas diferentes massas. O isótopo com massa 1 é o mais comum e não é radioativo. Já o isótopo com número de massa 2 é radioativo e dá origem às bombas de hidrogênio, e o isótopo com massa 3, ocorre em quantidades menores e é também radioativo.
Isótopos do Carbono:

O isótopo de Carbono 14 é um radioisótopo artificial, embora também exista na atmosfera, já o Carbono 12 é o mais comum na natureza, está presente no diamante, na grafite, etc.
O Carbono 14 é responsável por decifrar a idade de fósseis antigos, e por isso é elemento base na Arqueologia.
Isótopos do Urânio:

O isótopo de Urânio 238 não é radioativo, mas o 235 sim, e é usado para construir os reatores nucleares e as bombas atômicas.
Isótopos do Cobalto:
.jpg)
O Cobalto com número de massa 59 é o isótopo natural, já o Cobalto 60 é fabricado de modo artificial pelo bombardeamento do isótopo 59 com nêutrons. Este último é aplicado no tratamento de tumores. Veja a figura que ilustra o processo de bombardeamento do átomo de Cobalto:
.jpg)
Repare que um nêutron (indicado pela seta vermelha) colide com o núcleo de Cobalto modificando-o, neste instante ele adquire a propriedade radioativa e passa a emitir raios gama (indicado pela seta preta à direita).
O Cobalto 59 possui 27 prótons e 32 nêutrons (27+32 = 59), com o ganho de mais um nêutron passa a adquirir massa total = 60.
Os radioisótopos são muito úteis na agricultura, na engenharia, na medicina, etc., é importante lembrar que apresentam um alto grau de periculosidade e por isso são manipulados somente com o auxílio de robôs.
Meia-vida, também conhecida como período de semidesintegração, é o tempo necessário para que metade do número de átomos do isótopo radioativo presente em uma amostra desintegre-se.
→ Desintegrações
A desintegração não está relacionada com a extinção do átomo, ou seja, o átomo não deixa de existir. Na verdade, o que ocorre é o decaimento natural que o átomo sofre. No decaimento, o átomo (X), ao emitir radiação alfa e beta, transforma-se automaticamente em um novo elemento químico (Y), o que ocorre incessantemente até que o átomo deixe de ser radioativo (átomo estável).
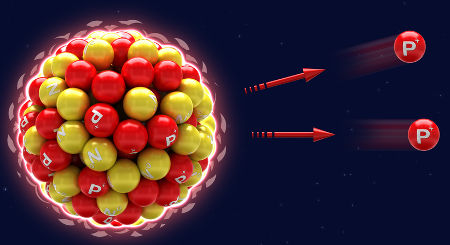
Representação do decaimento natural a partir de emissões alfa (prótons)
X → α + Y
Ou
X → β + Y
Se o átomo Y formado no decaimento for radioativo, novas radiações alfa e beta serão emitidas do núcleo desse átomo. Quando se chega à meia-vida de um material, sabemos que metade dos átomos que existiam na amostra tornou-se estável.
→ Meia-vida dos isótopos
Cada isótopo radioativo apresenta uma meia-vida diferente. Essa meia-vida pode ser expressa em segundos, minutos, horas, dias e anos. A tabela abaixo traz a meia-vida de alguns isótopos radioativos:
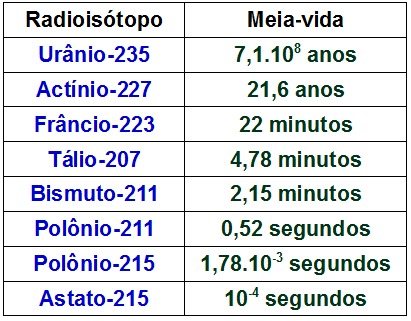
Valores da meia-vida de alguns radioisótopos
→ Fórmulas utilizadas no estudo de meia-vida
O período de meia-vida é representado pela sigla P. Já o tempo que um material sofreu desintegração é representado por t. Assim, se conhecemos a meia-vida e o tempo de desintegração (representado por x), podemos afirmar por quantas meias-vidas um material passou até certo momento. Isso é feito por intermédio da relação abaixo:
t = x . P
Com esse conhecimento, podemos ainda determinar o número de átomos que resta após o período de meia-vida a partir da expressão:
n = no
2x
n = número de átomos radioativos que resta na amostra;
no = número de átomos radioativos que havia na amostra;
x = número de meias-vidas que se passaram.
Além do cálculo do número de átomos propriamente dito, a desintegração ou a diminuição da quantidade do material radioativo após um período de meia-vida pode ser expressa das seguintes formas:
→ Em forma de porcentagem:
Pr = Po
2x
Pr = porcentagem de material radioativo que resta na amostra;
Po = porcentagem inicial de material radioativo que havia na amostra (sempre será 100%);
x = número de meias-vidas que se passaram.
→ Em forma de massa:
m = mo
2x
m = massa do material radioativo que resta na amostra;
mo = massa do material radioativo que havia na amostra;
x = número de meias-vidas que se passaram.
→ Em forma de números fracionários (fração):
F = No
2x
F = fração referente ao material radioativo que resta na amostra;
No = quantidade referente ao material radioativo que havia na amostra, que, na realidade, é sempre o número 1 no caso de exercícios que envolvem fração;
x = número de meias-vidas que se passaram.
→ Exemplos de cálculos envolvendo meia-vida
Acompanhe agora alguns exemplos de cálculos que envolvem meia-vida:
Exemplo 1: Após 12 dias, uma substância radioativa tem sua atividade reduzida para 1/8 da inicial. Qual é a meia-vida dessa substância?
Dados do Exercício:
Meia-vida (P) = ?
Tempo total (t) = 12 dias
Fração restante (F) = 1/8
Quantidade inicial (No) = 1
Temos que determinar o número de meias-vidas (x) sofridas pelo material na seguinte expressão:
F = No
2x
1 = 1
8 2x
2x.1 = 8.1
2x = 8
2x = 23
x = 3
Em seguida, determinamos o valor da meia-vida utilizando o valor de x encontrado e o tempo fornecido pelo enunciado:
t = x.P
12 = 3.P
12 = P
3
P = 4 dias
Exemplo 2: Um elemento radioativo tem meia-vida igual a 5 minutos. Dispondo-se de 6 g desse elemento, qual será a sua massa após 20 minutos?
Dados do Exercício:
Meia-vida (P) = 5 minutos
Massa inicial (mo) = 6 g
Tempo total = 20 minutos
Massa restante (m) = ?
Inicialmente determinamos o valor da quantidade de meias-vidas (x) que o material sofreu por meio do tempo e da meia-vida fornecidos:
t = x.P
20 = x.5
20 = x
5
x = 4
Por fim, calculamos a massa restante por meio do valor de x e da massa inicial na seguinte expressão:
m = mo
2x
m = 6
24
m = 6
16
m = 0,375 g
Exemplo 3: Um elemento radioativo tem uma meia-vida de 20 minutos. Após quanto tempo a sua massa se reduzirá para 25% da massa inicial?
Dados do Exercício:
Meia-vida (P) = 20 minutos
Tempo total (t) = ?
Porcentagem restante (Pr) = 25%
Porcentagem inicial (Po) = 100%
Temos que determinar o número de meias-vidas (x) sofridas pelo material na seguinte expressão:
Pr = Po
2x
25 = 100
2x
2x.25 = 100
2x = 100
25
2x = 4
2x = 22
x = 2
Em seguida, determinamos o valor do tempo utilizando o valor de x encontrado e a meia-vida fornecida pelo enunciado:
t = x.P
t = 2.20
t = 40 minutos
Por Me. Diogo Lopes Dias
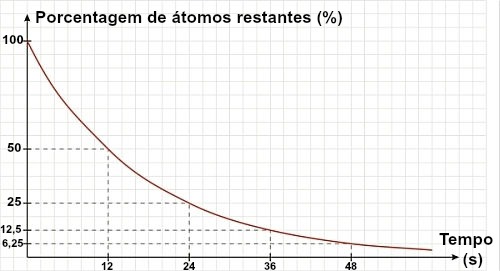
Datação do Carbono 14
O carbono 14 é formado a partir da colisão entre raios cósmicos e o nitrogênio 14, encontrando na atmosfera terrestre.
Esse isótopo do carbono liga-se facilmente com o oxigênio, formando o gás carbônico (14CO2), que é absorvido pelas plantas. Quando um ser vivo morre, a quantidade de carbono 14 diminui, o que implica em um decaimento radioativo.
O tempo de meia vida do carbono 14 (14C) é de 5730 anos. Isto significa que se um organismo morreu há 5730 anos terá a metade do conteúdo de 14C.
O tempo de meia vida de um elemento radioisótopo é o tempo necessário para que se desintegre a metade de sua massa, que pode ocorrer em segundos ou em bilhões de anos, dependendo do grau de intensidade do radioisótopo. Ou seja, se tivermos 200 g de massa de um elemento radioativo, cujo tempo de meia vida é de 10 anos, após esses 10 anos o elemento terá 100 g de massa. Assim sendo, a idade radiocarbono da amostra fóssil pode ser obtida comparando a radioatividade específica 14C/12C desta amostra. Nesse caso, quanto menor é a quantidade de carbono 14 encontrada na amostra mais antiga ela é.
Para descobrir a quanto tempo um organismo morreu, determina-se a quantidade de elétrons que o organismo emitiu por minuto por grama de material, que hoje em dia é de aproximadamente de 15 elétrons emitidos por minuto por grama de amostra.

O decaimento sofrido pelo carbono é de qual tipo?
Resolução:
Analisando a reação mostrada no enunciado do exercício, é possível perceber que não há mudança no número de massa (A = 14) antes e após o decaimento, o que indica que a partícula emitida apresenta massa muito pequena. Percebe-se que seu número atômico (carga elétrica) aumenta de Z = 6 para Z = 7, indicando que o carbono 14 perde uma carga negativa. Podemos dizer, portanto, que foi emitido um elétron, o que caracteriza um decaimento beta:
2) O elemento urânio é um radioisótopo físsil, isto é, pode sofrer diversos decaimentos nucleares, formando, assim, novos elementos. Em um desses decaimentos, o urânio dá origem ao elemento tório segundo a reação abaixo:
O tipo de decaimento sofrido pelo urânio nessa reação e a partícula X são, respectivamente:
a) decaimento alfa, elétron
b) decaimento alfa, núcleo do átomo de hélio
c) decaimento beta, radiação eletromagnética
d) decaimento gama, radiação eletromagnética
e) decaimento alfa, próton
Resolução:
Como o número de massa do elemento urânio cai de 235 para 231, fica fácil perceber que o decaimento sofrido por esse elemento é o decaimento alfa. A partícula emitida, nesse caso, é um núcleo do átomo de hélio, também chamada de partícula alfa, composta por dois nêutrons e dois prótons:
Resposta: B
3) O elemento bário-137 pode sofrer um decaimento como mostrado na reação abaixo:
O tipo de decaimento mostrado na reação acima e X são, respectivamente:
a) decaimento beta, ondas eletromagnéticas
b) decaimento alfa, núcleo do átomo de hélio
c) decaimento gama, radiação gama
d) decaimento alfa, elétrons
e) decaimento beta, pósitrons
Resolução:
Letra C
De acordo com a reação mostrada acima, o elemento bário não sofre quaisquer mudanças em sua massa da carga nuclear. Portanto, o resultado desse decaimento é a emissão de ondas eletromagnéticas conhecidas como radiação gama:
4) Numa reação de fissão nuclear, 1 g de urânio é fissionado, liberando uma quantidade de energia. Calcule essa energia.
Resolução:
De acordo com a relação de Einstein, a quantidade de energia obtida no processo de fissão nuclear é equivalente à energia de repouso da matéria, que pode ser calculada por meio da seguinte equação:
Usando a massa que sofreu fissão em kg (1 g = 0,001 kg), teremos o seguinte cálculo:
5) Sabendo que, após 15 minutos de observação, a massa da amostra de um isótopo radiativo sofre uma redução de 144 mg para 18 mg, qual será o valor da meia-vida desse isótopo?
Resolução:
Os dados fornecidos pelo exercício foram:
• Massa final (m): 18 mg;
• Massa inicial (mo): 144 mg;
• Tempo (t): 15 min.
Para determinar a meia-vida do isótopo, basta realizar os seguintes passos:
1º Passo: Calcular o número de meias-vidas que foram necessárias para a redução de 144 mg para 18 mg com a seguinte fórmula.
m = mo
2x
18 = 144
2x
2x = 144
18
2x = 8
Colocando os números 2 e 8 na mesma base:
2x = 23
x = 3
2º Passo: Em seguida, para obter a meia-vida, basta utilizar a seguinte expressão:
t = P.x
15 = P.3
15 = P
3
P = 5 minutos
Assistam a vídeo aula com o Professor João Brasil, através do link:
https://youtu.be/ZnuVKgdcVw4
Vídeo disponível no YouTube.
Agora façam os exercícios que seguem.
Exercícios.
1) Num reator de fissão nuclear é utilizado como combustível 1,2 g de urânio 235 (₉₂U²³⁸). Considerando a massa de urânio como massa de repouso, determine a energia liberada no reator.
Dado: c = 3.10⁸ m/s.
a) 1,8.10¹⁶ J
b) 3,6.10¹⁶ J
c) 2,6.10¹⁶ J
d) 1,5.10¹⁴ J
e) 1,08.10¹⁴ J
2) Na sequência radioativa:
temos, sucessivamente, quais emissões?
a) β, α, α, β
b) α, β, β, α.
c) α, γ, γ, α.
d) γ, β, β, γ.
e) α, β, γ, α.
3) O urânio é um elemento instável, portando emite radiação. Observe a transmutação sofrida pelo urânio:
₉₂U²³⁸ → ₂He⁴ + ₉₀Th²³⁴
Podemos afirmar que o decaimento radioativo sofrido pelo urânio ocorre através de:
a) emissão gama.
b) emissão beta.
c) emissão alfa.
d) emissão de radiação eletromagnética.
e) emissão de radiação infravermelha.
4) Um radioisótopo utilizado no tratamento radioterápico apresenta uma meia-vida (período de semidesintegração) de 5 horas. Se um técnico utilizar uma massa de 50 g no tratamento de um paciente, após quantas horas a massa seria reduzida para 6,25 g?
a) 5 horas.
b) 25 horas.
c) 30 horas.
d) 15 horas.
e) 10 horas.
5) Medidas de radioatividade de uma amostra de tecido vegetal encontrado nas proximidades do Vale dos Reis, no Egito, revelaram que o teor em carbono 14 (a relação 14C/12C) era correspondente a 25% do valor encontrado para um vegetal vivo.
Sabendo que a meia-vida do carbono 14 é 5730 anos, conclui-se que o tecido fossilizado encontrado não pode ter pertencido a uma planta que viveu durante o antigo império egípcio – há cerca de 6000 anos –, pois:
a) ele pertenceu a um vegetal que morreu há cerca de 11500 anos.
b) para que fosse alcançada essa relação 14C/12C no tecido vegetal, seriam necessários apenas cerca de 3000 anos.
c) a relação 14C/12C de 25%, em comparação com a de um tecido vegetal vivo, corresponde à passagem de, aproximadamente, 1500 anos.
d) a meia-vida do carbono 14 é cerca de 1000 anos menor do que os 6000 anos do império egípcio.
e) ele é relativamente recente, tendo pertencido a uma planta que viveu há apenas 240 anos, aproximadamente.

.jpg)
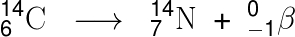

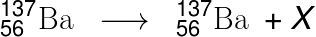
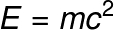

Nenhum comentário:
Postar um comentário
Não esqueça de colocar seu nome completo e série/ano turma