* Leiam o texto com atenção e observem os exemplos.
* Assistam às vídeo aulas pelo CMSP, TV e plataforma Stoodi.
* Identifiquem as atividades com nome, turma, série e n° de chamada (se possível).
* Enviem as atividades para o E-mail: josecorreia@prof.educacao.sp.gov.br
* Pesquisem em livros didáticos ou pela internet.
* Data de entrega: até 18/08.
Curvas de aquecimento e de resfriamento.
Ao estudarmos os conceitos de Calor, vimos que quando dois corpos com temperaturas diferentes são colocados em contato térmico, a temperatura do corpo mais quente começa a diminuir enquanto a do corpo mais frio começa a aumentar. Dessa forma, dizemos que o corpo mais quente perde energia na forma de calor para o corpo com menor energia térmica. Vimos também que a quantidade de calor que um corpo recebe ou perde (calor sensível) é proporcional à sua massa e à variação de temperatura. Já a quantidade de calor que um corpo perde ou cede para fazê-lo mudar de fase é diretamente proporcional à sua massa.
Todos esses processos, trocas de calor e mudanças de fase necessitam de acréscimo ou perda de energia térmica na forma de calor. Com informações da quantidade de calor sensível e calor latente de uma substância, temos condições de montar o diagrama de temperatura em função da quantidade de calor absorvida.
Imaginemos que, de uma forma constante, fornecemos calor a uma substância de m gramas, que inicialmente encontra-se na fase sólida. As etapas a que esta substância está sujeita são, em ordem:
- Aquecimento na fase sólida, desde a temperatura inicial θ0 até seu ponto de fusão (P.F.).
- Fusão da substância, ocorre com a temperatura constante no ponto de fusão (P.F.).
- Aquecimento na fase líquida, do ponto de fusão (P.F.) até o ponto de vaporização ou ebulição (P.E.).
- Vaporização da substância, ocorre com a temperatura constante no ponto de ebulição (P.E.).
- Aquecimento na fase gasosa, do ponto de vaporização ou ebulição (P.E.) até uma temperatura final θ.
Essas etapas, colocadas no diagrama de temperatura em função da quantidade de calor absorvida, correspondem à curva de aquecimento da substância representada na figura acima. Para se calcular as quantidades de calor absorvidas pela substância, é necessário levar em conta os trechos em que há variação da temperatura (quantidade de calor sensível) ou mudança de fase (quantidade de calor latente). Assim, temos:
trecho AB: QS= Q1-0=m .cs .(P.F.- θ0 )
trecho BC: Q1= Q2-Q1=m .LF
trecho CD: Q'S= Q3-Q2=m .cL .(P.E.- P.F.)
trecho DE: Q'L= Q4-Q3=m .LV
trecho EF: Q''S= Q5-Q4=m .cv .(θ-P.E.)
trecho BC: Q1= Q2-Q1=m .LF
trecho CD: Q'S= Q3-Q2=m .cL .(P.E.- P.F.)
trecho DE: Q'L= Q4-Q3=m .LV
trecho EF: Q''S= Q5-Q4=m .cv .(θ-P.E.)
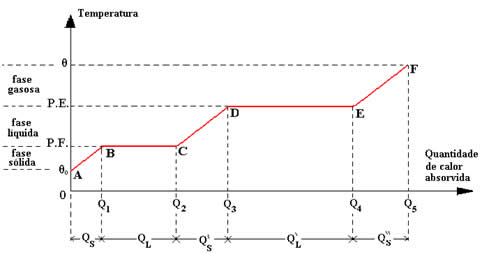
Gráfico (diagrama) de temperatura em função da quantidade de calor absorvida
As regiões em que a linha vermelha está inclinada, indicam aumento de temperatura, ou seja, calor sensível ( Q = m . c ( Θf - Θi ) ).
As regiões em que a linha vermelha está plana (patamar), indica mudança de estado físico, ou seja, calor latente ( Q = m . L ).
Lembrando que o calor sensível ocorre quando há variação de temperatura sem mudar o estado físico, e o calor latente ocorre quando há mudança de estado físico sem haver variação de temperatura.
O gráfico abaixo é a cuva de aquecimento de um bloco de gelo à -50°C que recebe calor e se transforma totalmente em vapor de água que continua recebendo calor.
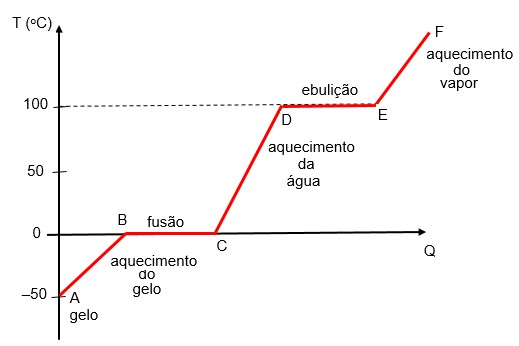
AB representa o aquecimento do gelo.
BC representa a fusão do gelo.
CD representa o aquecimento da água que se forma da fusão do gelo.
DE representa a ebulição da água.
EF representa o aquecimento do vapor de água.
Lembrando que para a água, temos os seguintes valores de calor latente:
* calor latente de fusão do gelo: Lf = 80 cal/g
* calor latente de solidificação da água: Ls = -80 cal/g
* calor latente de vaporização ou ebulição da água: Lv = 540 cal/g
* calor latente de condensação do vapor de água: Lc = -540 cal/g

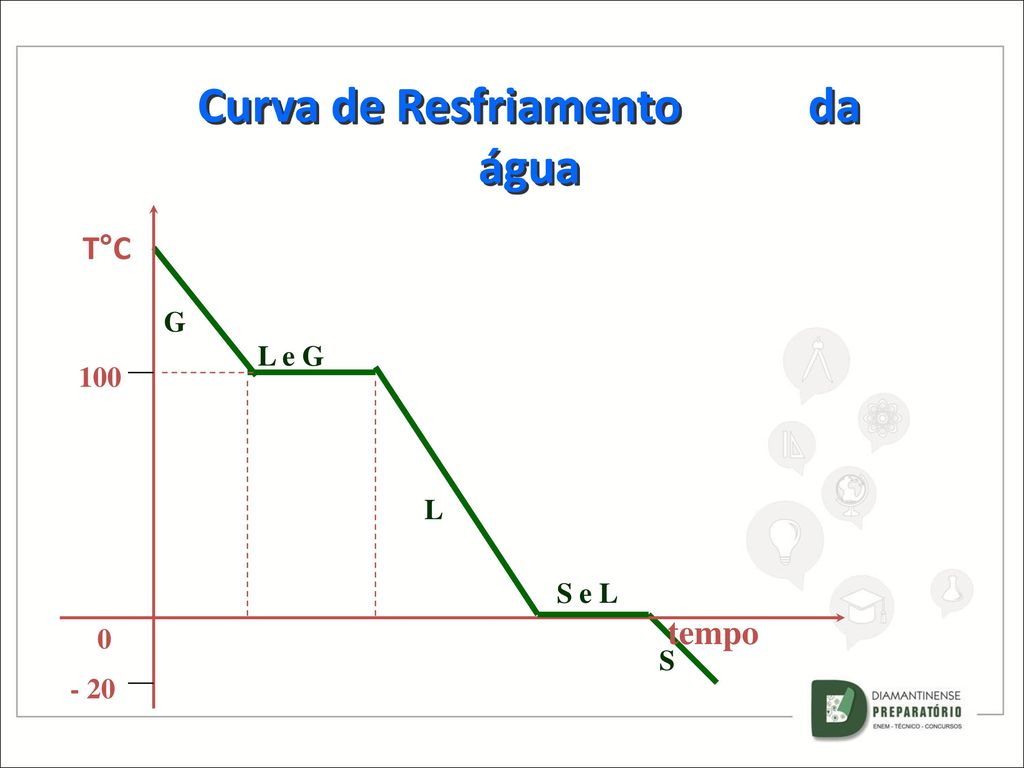
Agora observe o gráfico abaixo, ele representa a curva de resfriamento do vapor de água.
Exemplos.
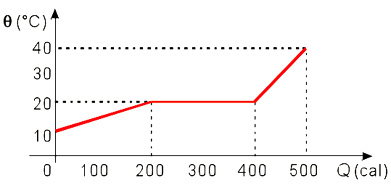
1) O gráfico representa o aquecimento de 50 g de uma substância que se encontra inicialmente no estado sólido.

a) Qual é o calor específico da substância?
b) Qual é o calor latente de fusão da substância?
c) Qual é o ponto de fusão da substância?
Resolução:
a) O calor específico é calculado pela fórmula: Q = m . c . (Θf - Θi), ou seja, calor sensível.
Q = m . c . (Θf - Θi)
200 - 0 = 50 . c . (20 - 10)
200 = 50c . 10
200 = 500c
200/500 = c
c = 0,4 cal/g.°C
b) A substância sofre a fusão na região plana do gráfico (patamar).
Q = m . Lf
400 - 200 = 50 . Lf
200 = 50 . Lf
200/50 = Lf
Lf = 4 cal/°C
c) O ponto de fusão é a temperatura em que a substância sofre a fusão, ou seja, 20°C.
2) O gráfico abaixo apresenta a curva de aquecimento de uma substância pura de massa 100 g, inicialmente no estado sólido.
Determine para esta substância:
a) A temperatura de fusão
b) A temperatura de ebulição
c) O calor latente de fusão
d) O calor latente de vaporização
e) O calor específico no estado sólido
f) O calor específico no estado líquido
g) O calor específico no estado de vapor
Resolução:
a) 50°C
b) 150°C
c) Q = m . Lf
9000 - 3000 = 100 . Lf
6000 = 100 . Lf
6000/100 = Lf
Lf = 60 cal/g
d) Q = m . Lv
24000 - 15000 = 100 . Lv
9000 = 100 . Lv
9000/100 = Lv
Lv = 90 cal/g
e) Q = m . c . (Θf - Θi)
3000 - 0 = 100 . c . (50 - 10)
3000 = 100c . 40
3000 = 4000c
3000/4000 = c
c = 0,75 cal/g.°C
f) Q = m . c . (Θf - Θi)
15000 - 9000 = 100 . c . (150 - 50)
6000 = 100c . 100
6000 = 10000c
6000/10000 = c
c = 0,6 cal/g.°C
g) Q = m . c . (Θf - Θi)
27000 - 24000 = 100 . c . (200 - 150)
3000 = 100c . 50
3000 = 5000c
3000/5000 = c
c = 0,6 cal/g.°C
Agora faça os exercícios.
Exercícios.
1) O gráfico representa o aquecimento de 100g de uma substância que se encontra inicialmente no estado sólido.

Podemos afirmar que o calor latente de fusão dessa substância é de:
a) 6 cal/g
b) 0,6 cal/g
c) 60 cal/g
d) 12 cal/g
e) 20 cal/g
2) A curva de aquecimento abaixo, representa o aquecimento de uma substância que se encotra inicialmente no estado sólido.

De acordo com o gráfico, o ponto de ebulição dessa substância é:
a) 15°C
b) 35°C
c) 15000 cal
d) 85°C
e) 18000 cal
3) O gráfico abaixo representa o aquecimento de 50 g de uma substância que se encontra inicialmente no estado líquido.
Podemos afirmar que que o calor específico da substância no estado líquido é:
a) 0,2 cal/g.°C
b) 0,4 cal/g.°C
c) 0,5 cal/g.°C
d) 0,6 cal/g.°C
e) 0,8 cal/g.°C
4) O gráfico abaixo indica o aquecimento de 80 g de uma substância que se encontra inicialmente no estado sólido.

Podemos afirmar que o calor específico dessa substância no estado líquido é:
a) 0,5 cal/g.°C
b) 0,54 cal/g.°C
c) 0,6 cal/g.°C
d) 0,7 cal/g.°C
e) 0,75 cal/g.°C
5) Em relação ao exercício anterior, qual é o calor latente de ebulição dessa substância?
a) 150 cal/g
b) 120 cal/g
c) 112,5 cal/g
d) 110 cal/g
e) 102,5 cal/g
Podemos afirmar que o calor latente de fusão dessa substância é de:
a) 6 cal/g
b) 0,6 cal/g
c) 60 cal/g
d) 12 cal/g
e) 20 cal/g
2) A curva de aquecimento abaixo, representa o aquecimento de uma substância que se encotra inicialmente no estado sólido.

De acordo com o gráfico, o ponto de ebulição dessa substância é:
a) 15°C
b) 35°C
c) 15000 cal
d) 85°C
e) 18000 cal
3) O gráfico abaixo representa o aquecimento de 50 g de uma substância que se encontra inicialmente no estado líquido.

Podemos afirmar que que o calor específico da substância no estado líquido é:
a) 0,2 cal/g.°C
b) 0,4 cal/g.°C
c) 0,5 cal/g.°C
d) 0,6 cal/g.°C
e) 0,8 cal/g.°C
4) O gráfico abaixo indica o aquecimento de 80 g de uma substância que se encontra inicialmente no estado sólido.

Podemos afirmar que o calor específico dessa substância no estado líquido é:
a) 0,5 cal/g.°C
b) 0,54 cal/g.°C
c) 0,6 cal/g.°C
d) 0,7 cal/g.°C
e) 0,75 cal/g.°C
5) Em relação ao exercício anterior, qual é o calor latente de ebulição dessa substância?
a) 150 cal/g
b) 120 cal/g
c) 112,5 cal/g
d) 110 cal/g
e) 102,5 cal/g
Nenhum comentário:
Postar um comentário
Não esqueça de colocar seu nome completo e série/ano turma