* Leia co atenção e observe os exemplos.
* Assistam às aulas pelo CMSP, TV, vídeo aulas pela plataforma Stoodi e pesquisem em livros didáticos ou pela internet.
* Não esqueçam de identificar as atividades com nome, ano, turma e n° de chamada ( se possível ).
* Enviem as atividades para o E-mail: josecorreia@prof.educacao.sp.gov.br
* Data de entrega: até 21/07.
Tipos de calor.
Calor é a energia que passa de um corpo de maior temperatura para outro de menor temperatura.
Há dois tipos de calor, o calor sensível e o calor latente.
O calor sensível provoca variação de temperatura sem mudança no estado físico da matéria.
O calor latente provoca mudança no estado físico da matéria sem variação de temperatura.
Imagine a seguinte situação:
Um bloco de gelo à -10°C é aquecido. Esse aquecimento se dá em etapas.
1ª) O bloco de gelo recebe calor até que sua temperatura atinja 0°C (ponto de fusão do gelo).
2ª) Ao atingir a temperatura de 0°C o gelo começa a derreter ( fusão ). Durante a derretimento do gelo (mudança de estado físico de sólido para líquido) a temperatura permanece constante, até que toda o massa de gelo derreta ( calor latente ).
3ª) Após toda a massa de gelo ter derretida, a água formada pelo derretimento começa a ser aquecida até 100°C ( calor sensível ).
4ª) Ao atingir a temperatura de 100°C, a água começa a se transformar em vapor de água ( calor latente ).
5ª) Após toda massa de água se transformar em vapor de água, se continuar a receber calor, a temperatura do vapor de água sofrerá variação ( calor sensível ).
Analisando cada uma das etapas acima, temos:
1ª) Houve variação de temperatura do gelo de -10°C à 0°C, sem mudança de estado físico, portanto o calor recebido é sensível.
2ª) Ocorre a fusão do gelo, mudança de estado físico sem variação de temperatura, portanto o calor é latente.
3ª) A água sofre variação de temperatura sem mudar o estado físico, calor sensível.
4ª) A água sofre vaporização, muda de estado físico sem haver variação de temperatura, calor latente.
5ª) O vapor de água sofre variação de temperatura sem mudar de estado físico, calor sensível.
Como se pode observar:
O calor sensível muda a temperatura mas não muda o estado físico.
O calor latente muda o estado físico sem variar a temperatura.
Assim podemos concluir que em uma panela com água no fogo, podemos abaixar a chama do fogão, pois a temperatura da água não aumenta mais, poi ao atingir 100°C a água muda de estado físico.
Observação.
Esses dados de temperatura são em condições normais de temperatura e pressão (CNTP), ou seja, ao nível do mar, cuja pressão é de 1atm ( atmosfera, medida de pressão).
Quanto maior a altitude, menor é a pressão atmosférica, e menor será a temperatura em que ocorre a mudança de estado físico.
No alto de uma montanha é difícil até de se cozinhar uma batata, pois devido a altitude, a água ebtra em ebulição a temperatura de 72°C, por exemplo.
Na panela de pressão, a água entra em ebulição a uma temperatura de 120°C, devido à pressão ser maior dentro da panela. Por esse motivo os alimentos cozinham mais rapidamente.
Fórmulas.
* Calor sensível.
Q = m . c . (Θf - Θi) ou Q = C . ΔΘ
Onde:
Q = quantidade de calor ( calorias(cal) ou joule(J) )
m = massa ( gramas(g) )
c = calor específico ( cal/g.ºC )
Θf = temperatura final (°C)
Θi = temperatura inicial (°C)
ΔΘ = variação de temperatura (ΔΘ = Θf - Θi)
C = capacidade térmica ( cal/°C)
* Calor latente.
Q = m . L
Onde:
Q = quantidade de calor ( calorias(cal) ou joule(J) )
m = massa ( gramas(g) )
L = calor latente (cal/g)
Para a água, temos os seguintes valores de calor latente:
Lf = 80 cal/g (calor latente de fusão)
Ls = -80 cal/g ( calor latente de solidificação )
Lv = 540 cal/g ( calor latente de vaporização )
Lc = -540 cal/g (calor latente de condensação)

Observação: os valores acima não podem ser esquecidos. Sempre serão os mesmos para a água.
Quando recebe calor, o valor é positivo.
Quando perde calor, o valor é negativo.
Exemplos.
1) Calcule a quantidade de calor necessária para que um bloco de 200g de gelo à 0°C se transforme completamente em água à 20°C. Dado: calor específico da água c = 1cal/g.°C.
Resolução:
1°) Observe que ocorre apenas mudança de estado físico, portanto o calor é latente.
Q = m . Lf
Q = 200 . 80
Q = 16000cal.
2°) A água proveniente do derretimento do gelo está à 0°C, e será aquecida até 20°C. Portanto o calor é sensível.
Q = m . c . (Θf - Θi)
Q = 200 . 1 . (20 - 0)
Q = 200 . 20
Q = 4000cal
3°) Agora vamos somar as quantidades de calor.
Qt = Q1 + Q2
Qt = 16000 + 4000
Qt = 20000cal ou 20Kcal.
2) Um bloco de gelo de 500g está à -5°C. Determine a quantidade de calor necessária para transformar-lo totalmente em vapor de água à 100°C. Dados: calor específico da água c = 1cal/g.°C e calor específico do gelo c = 0,5cal/g.°C, Lf = 80cal/g, Lv = 540cal/g.
Resolução:
Esse exercícios será dividido em quatro etapas:
1ª) Aquecimento do gelo de -5°C até 0°C ( calor sensível)
Q = m . c . (Θf - Θi)
Q = 500 . 0,5 . (0 - (-5))
Q = 250 . 5
Q = 1250cal
2ª) Fusão do gelo (calor latente)
Q = m .Lf
Q = 500 . 80
Q = 40000cal
3ª) Aquecimento da água de 0°C à 100°C (calor sensível)
Q = m . c . (Θf - Θi)
Q = 500 . 1 . (100 - 0)
Q = 500 . 100
Q = 50000cal
4ª) Vaporização da água (calor latente)
Q = m . Lv
Q = 500 . 540
Q = 270000cal
Agora vamos somar as quantidades de calor de cada etapa.
Qt = Q1 + Q2 + Q3 + Q4
Qt = 1250 + 40000 + 50000 + 270000
Qt = 361250cal ou 361,25Kcal

O gráfico acima é chamado de curva de aquecimento. Os patamares do gráfico ( S + L) e ( L + G), indicam mudança de estado físico ( calor latente) e nas linhas crescentes, onde ocorre variação de temperatura, calor sensível.
3) Dado o diagrama de aquecimento de um material:
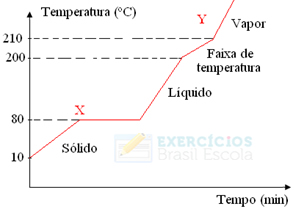
Resolução:
1°) Observe que ocorre apenas mudança de estado físico, portanto o calor é latente.
Q = m . Lf
Q = 200 . 80
Q = 16000cal.
2°) A água proveniente do derretimento do gelo está à 0°C, e será aquecida até 20°C. Portanto o calor é sensível.
Q = m . c . (Θf - Θi)
Q = 200 . 1 . (20 - 0)
Q = 200 . 20
Q = 4000cal
3°) Agora vamos somar as quantidades de calor.
Qt = Q1 + Q2
Qt = 16000 + 4000
Qt = 20000cal ou 20Kcal.
2) Um bloco de gelo de 500g está à -5°C. Determine a quantidade de calor necessária para transformar-lo totalmente em vapor de água à 100°C. Dados: calor específico da água c = 1cal/g.°C e calor específico do gelo c = 0,5cal/g.°C, Lf = 80cal/g, Lv = 540cal/g.
Resolução:
Esse exercícios será dividido em quatro etapas:
1ª) Aquecimento do gelo de -5°C até 0°C ( calor sensível)
Q = m . c . (Θf - Θi)
Q = 500 . 0,5 . (0 - (-5))
Q = 250 . 5
Q = 1250cal
2ª) Fusão do gelo (calor latente)
Q = m .Lf
Q = 500 . 80
Q = 40000cal
3ª) Aquecimento da água de 0°C à 100°C (calor sensível)
Q = m . c . (Θf - Θi)
Q = 500 . 1 . (100 - 0)
Q = 500 . 100
Q = 50000cal
4ª) Vaporização da água (calor latente)
Q = m . Lv
Q = 500 . 540
Q = 270000cal
Agora vamos somar as quantidades de calor de cada etapa.
Qt = Q1 + Q2 + Q3 + Q4
Qt = 1250 + 40000 + 50000 + 270000
Qt = 361250cal ou 361,25Kcal
O gráfico acima é chamado de curva de aquecimento. Os patamares do gráfico ( S + L) e ( L + G), indicam mudança de estado físico ( calor latente) e nas linhas crescentes, onde ocorre variação de temperatura, calor sensível.
3) Dado o diagrama de aquecimento de um material:

A alternativa correta é:
a) o diagrama representa o resfriamento de uma substância pura.
b) a temperatura no tempo zero representa o aquecimento de um líquido.
c) 210°C é a temperatura de fusão do material.
d) a transformação de X para Y é um fenômeno químico.
e) 80°C é a temperatura de fusão do material.
Resolução:
a) Falso. O gráfico representa o aquecimento, pois a temperatura aumenta com o passar do tempo.
b) Falso. A substância em t = 0 está no estado sólido.
c) Falso. 210°C é a temperatura de vaporização do material.
d) Falso. É um fenômeno físico, pois só ocorre mudança de estado físico e não mudança na substância.
e) Verdadeiro. A fusão do material ocorre na temperatura de 80°C
Resposta: E.
Agora faça você.
Exercícios.
1) Calcule a quantidade de calor necessária para que um bloco de 400g de gelo à 0°C se transforme completamente em água à 25°C. Dado: calor específico da água c = 1cal/g.°C.
a) 32 Kcal
b) 42 Kcal
c) 10 Kcal
d) 25 Kcal
e) 40 Kcal
2) Um bloco de gelo de 200g está à -10°C. Determine a quantidade de calor necessária para transformar-lo totalmente em vapor de água à 100°C. Dados: calor específico da água c = 1cal/g.°C e calor específico do gelo c = 0,5cal/g.°C, Lf = 80cal/g, Lv = 540cal/g.
a) 1000 cal
b) 16 Kcal
c) 20 Kcal
d) 120 Kcal
e) 145 Kcal
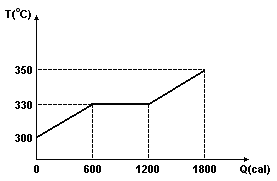
3) Observe a curva de aquecimento representada abaixo. Nela está indicado o aquecimento de 50g de uma substância, inicialmente no estado sólido.
De acordo com o gráfico, a temperatura de fusão dessa substância é de:
a) 300°C
b) 600 cal
c) 330°C
d) 1200 cal
e) 350°C
4) O diagrama abaixo representa a curva de aquecimento de 20 gramas de uma substância inicialmente no estado líquido. Qual o calor latente de vaporização dessa substância ?
a) 10 cal/g
b) 5 cal/g
c) 15 cal/g
d) 20 cal/g
e) 25 cal/g
5) Um recipiente armazena 500 g de água no estado líquido. Sem que haja mudanças na temperatura da água, repentinamente, todo o seu conteúdo é evaporado. Determine a quantidade de calor que foi transferida para o conteúdo desse recipiente.
Dados: LF = 540 cal/g
a) 540 Kcal
b) 340 Kcal
c) 250 Kcal
d) 270 Kcal
e) 320 Kcal

Nenhum comentário:
Postar um comentário
Não esqueça de colocar seu nome completo e série/ano turma