Recomendações aos alunos:
* Leiam com atenção e observem os exemplos.
* Assistam às vídeo aulas pelo CMSP, TV, plataforma Stoodi e façam pesquisas em livros didáticos ou pela internet.
* Identifiquem as atividades com nome, série, turma, nº de chamada, título da atividade e a data de postagem no blog.
* Enviem as atividades para o E-mail: josecorreia@prof.educacao.sp.gov.br
* Data de entrega: até 24/11.
* Para os alunos que entregam as atividades regularmente, essa é a ultima atividade que deve ser enviada.
Olá pessoal! Que todos estejam bem.
Nessa semana vamos estudar os gases.
Um gás não possui forma própria nem volume constante. O gás ocupa todo o volume do recipiente que o contém e a sua forma também.
Para o estudo de um gás devemos levar em consideração três grandezas, que são chamadas de variáveis se estado de um gás. São elas: pressão (P), volume (V) e temperatura (T).
* PRESSÃO DE UM GÁS: é a força aplicada pelo gás nas paredes do recipiente que o contém.
P = F/A
Onde:
P = pressão
F = força (newton (N))
A = área (m²)
No S.I. a unidade de medida da pressão é o pascal (Pa). Porém existem várias unidades de medida de pressão. A pressão pode ser medida em:
* newtons por metro quadrado (N/m²): 1 Pa = 1 N/m²
* bar (bar): 1 bar = 10⁵ Pa
* atmosfera (atm): 1 atm = 10⁵ Pa
* milímetros de mercúrio (mmHg): 1 atm = 760 mmHg
* libra-força por polegada quadrada (psi), do inglês "pound per square inch": 1 psi = 6,9.10³ Pa
* torricelli (Torr): 1 Torr = 133,3 Pa
- VOLUME DO GÁS.
No S.I. a unidade de medida de volume é o metro cúbico (m³). Porém, são utilizadas outras unidade como o centímetro cúbico (cm³) e o litro (l).
1 m³ = 10⁶ cm³ = 10³ l
* TEMPERATURA DE UM GÁS.
A temperatura de um gás deve estar na escala absoluta de temperatura, ou seja, na escala Kelvin (K).
Lembrando que para converter graus Celsius (°C) em Kelvin (K), podemos fazer de duas maneiras, utilizando a fórmula ou a regra prática.
Veja:
20°C = 293 K, pois:
T°C = TK - 273
5 5 ( denominadores iguais podem ser cancelados)
20 = TK - 273
20 + 273 = TK
TK = 293 K
Através da regra prática, basta somar 273 a temperatura em °C:
20 + 273 = 293 K
Quando um gás sofre variação em qualquer uma das variáveis de estado (pressão, volume, temperatura), dizemos que o gás sofreu uma transformação gasosa.
Lei Geral dos Gases Perfeitos
Procura relacionar em uma transformação de massa gasosa, as variáveis: temperatura, pressão e volume.
É representada pela equação matemática:
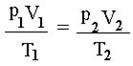
Onde:
p1 = pressão inicial
V1 = volume inicial
T1 = temperatura inicial
p2 = pressão final
V2 = volume final
T2 = temperatura final
Gases são fluidos no estado gasoso. A característica que os difere dos fluidos líquidos é que, quando colocados em um recipiente, estes têm a capacidade de ocupá-lo totalmente. A maior parte dos elementos químicos não-metálicos conhecidos são encontrados no seu estado gasoso, em temperatura ambiente.
As moléculas do gás, ao se movimentarem, colidem com as outras moléculas e com as paredes do recipiente onde se encontram, exercendo uma pressão, chamada de pressão do gás.
Esta pressão tem relação com o volume do gás e à temperatura absoluta.
Ao ter a temperatura aumentada, as moléculas do gás aumentam sua agitação, provocando mais colisões.
Ao aumentar o volume do recipiente, as moléculas tem mais espaço para se deslocar, logo, as colisões diminuem, diminuindo a pressão.
Utilizando os princípios da mecânica Newtoniana é possível estabelecer a seguinte relação:
Onde:
p=pressão
m=massa do gás
v=velocidade média das moléculas
V=volume do gás.
Gás perfeito ou ideal
É considerado um gás perfeito quando são presentes as seguintes características:
- o movimento das moléculas é regido pelos princípios da mecânica Newtoniana;
- os choques entre as moléculas são perfeitamente elásticos, ou seja, a quantidade de movimento é conservada;
- não há atração e nem repulsão entre as moléculas;
- o volume de cada molécula é desprezível quando comparado com o volume total do gás.
Energia cinética de um gás
Devido às colisões entre si e com as paredes do recipiente, as moléculas mudam a sua velocidade e direção, ocasionando uma variação de energia cinética de cada uma delas. No entanto, a energia cinética média do gás permanece a mesma.
Novamente utilizando-se conceitos da mecânica Newtoniana estabelece-se:
Onde:
n=número molar do gás (nº de mols)
R=constante universal dos gases perfeitos (R=8,31J/mol.K)
T=temperatura absoluta (em Kelvin)
O número de mols do gás é calculado utilizando-se sua massa molar, encontrado em tabelas periódicas e através da constante de Avogadro.
Utilizando-se da relação que em 1mol de moléculas de uma substância há moléculas desta substância.
* TRANSFORMAÇÕES GASOSAS.
As transformações gasosas podem ser de três tipos: isotérmicas, isobáricas ou isovolumétricas.
* TRANSFORMÇÃO ISOTÉRMICA.
A palavra isotérmica se refere à mesma temperatura. Logo, uma transformação isotérmica de um gás ocorre quando a temperatura inicial é conservada.
A lei física que expressa essa relação é conhecida com Lei de Boyle e é matematicamente expressa por:
Onde:
p=pressão
V=volume
=constante que depende da massa, temperatura e natureza do gás.
Como esta constante é a mesma para um mesmo gás, ao ser transformado, é válida a relação:
Além disso, essa lei também é representada graficamente:
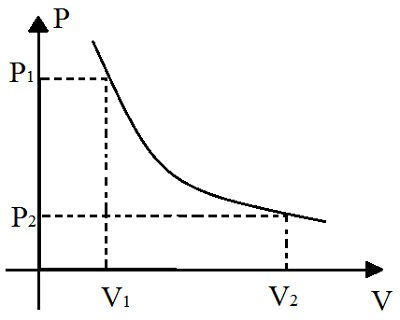
Esse gráfico representa a relação entre a variação de pressão e a variação de temperatura durante uma transformação isotérmica
A representação gráfica da transformação isotérmica é uma hipérbole. Quanto maior o produto p.V dessa transformação, mais afastada essa hipérbole ficará dos eixos do gráfico. O nome dado a essa curva representada no gráfico é Isoterma.
Exemplo:
Certo gás contido em um recipiente de 1m³ com êmbolo exerce uma pressão de 250Pa. Ao ser comprimido isotérmicamente a um volume de 0,6m³ qual será a pressão exercida pelo gás?
* TRANSFORMAÇÃO ISOBÁRICA.
Analogamente à transformação isotérmica, quando há uma transformação isobárica, a pressão é conservada.
Regida pela Lei de Charles e Gay-Lussac, esta transformação pode ser expressa por:
Onde:
V=volume;
T=temperatura absoluta;
=constante que depende da pressão, massa e natureza do gás.
Assim, quando um mesmo gás muda de temperatura ou volume, é válida a relação:
Gráficos da Transformação Isobárica
Relacionando as grandezas volume e temperatura, o gráfico é apresentado como um segmento de reta.
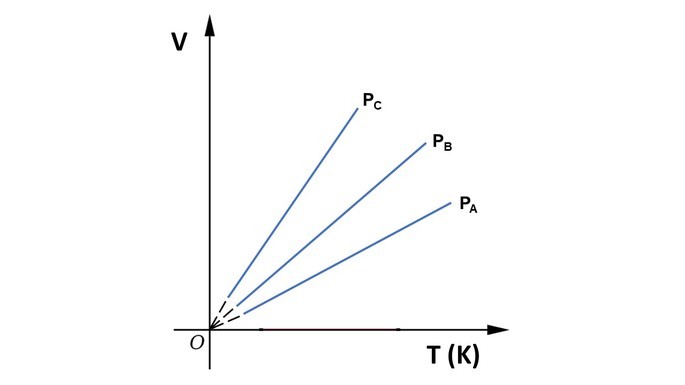
Se utilizarmos o diagrama para comparar três pressões diferentes de um mesmo gás, onde pa > pb > pc , a constante na relação é inversamente proporção à pressão e, por isso, ka < kb < kc. Portanto, a maior pressão apresenta a menor constante.
Através do gráfico com as grandezas volume e pressão é possível calcular o trabalho na transformação isobárica.
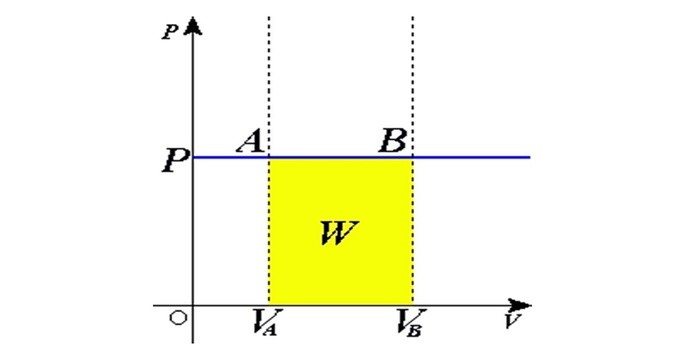
A área da figura corresponde ao trabalho, que pode ser calculada por:
Onde,
W: trabalho;
p: pressão constante;: variação de volume.
Exemplo:
Um gás de volume 0,5m³ à temperatura de 20ºC é aquecido até a temperatura de 70ºC. Qual será o volume ocupado por ele, se esta transformação acontecer sob pressão constante?
É importante lembrarmos que a temperatura considerada deve ser a temperatura absoluta do gás (escala Kelvin) assim, o primeiro passo para a resolução do exercício é a conversão de escalas termométricas:
Lembrando que:
Então:
* TRANSFORMAÇÃO ISOVOLUMÉTRICA, ISOMÉTRICA OU ISOCÓRICA.
A transformação isométrica também pode ser chamada isocórica e assim como nas outras transformações vistas, a isométrica se baseia em uma relação em que, para este caso, o volume se mantém.
Regida pela Lei de Charles, a transformação isométrica é matematicamente expressa por:
Onde:
p=pressão;
T=temperatura absoluta do gás;
=constante que depende do volume, massa e da natureza do gás.;
Como para um mesmo gás, a constante é sempre a mesma, garantindo a validade da relação:
Ou, graficamente, o enunciado volumétrico da Lei de Charles pode ser representado assim: 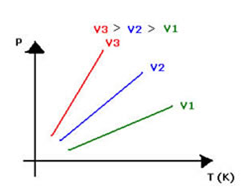 O gráfico da transformação isocórica representa a variação da pressão com a variação da temperatura ( em kelvin) e é sempre uma reta .
O gráfico da transformação isocórica representa a variação da pressão com a variação da temperatura ( em kelvin) e é sempre uma reta .
Exemplo:
1) Um gás que se encontra à temperatura de 200K é aquecido até 300K, sem mudar de volume. Se a pressão exercida no final do processo de aquecimento é 1000Pa, qual era a pressão inicial?
P1/T1 = P2/T2
2) Um recipiente indeformável, hermeticamente fechado, contém 10 litros de um gás perfeito a 30 ºC, suportando a pressão de 2 atmosferas. A temperatura do gás é aumentada até atingir 60º C. Calcule a pressão final do gás.
Resolução:
Considerando-se que o volume do gás é constante, temos que a transformação é isocórica.
T1 = 30° C + 273 =303 K
T2 = 60°C + 273 = 333 K
P1 = 2 atm
P2 =?
P1/T1 = P2/T2
2/303 = P2/333
2 . 333 = 303.P2
666/303 = P2
P2 = 2,2 atm
3)
.jpg)
O gráfico acima mostra a isoterma de uma quantidade de gás que é levado de um estado 1 para um estado 2. O volume do estado 2, em litros, é:
(a) 2 L
(b) 4,5 L
(c) 6 L
(d) 4 L
(e) 3 L
Resolução:
De acordo com o gráfico, temos:
P1 . V1 = P2 . V2
10 . 2 = 5 . V2
20 = 5. V2
20/5 = V2
V2 = 4 l
Resp: D
ASSISTAM A VÍDEO AULA COM O PROFESSOR MARCELO BOARO, ATRAVÉS DO LINK: https://youtu.be/XQ1EJDTNKpI
VÍDEO DISPONÍVEL NO YOUTYBE.
Agora façam os exercícios que seguem.
Bons estudos!
Exercícios.
1) Um carro-tanque transportou gás cloro para uma estação de tratamento de água. Sabe-se que o volume do tanque que continha gás cloro era de 30 m3, que a temperatura era mantida a 20oC para a pressão ser de 2 atm e que, na estação de tratamento de água, esse cloro foi transferido para um reservatório de 50 m3 mantido a 293 K. Ao passar do carro-tanque para o reservatório, o gás sofreu uma transformação........e a pressão do reservatório era.............. As lacunas são completamente preenchidas, respectivamente, com os dados:
a) isotérmica, 1,2 atm.
b) isométrica, 117 atm.
c) isobárica, 2 atm.
d) isocórica, 2 atm.
e) isovolumétrica, 1,2 atm.
2) O gráfico abaixo representa um processo cíclico (ciclo) a que é submetido um gás ideal:
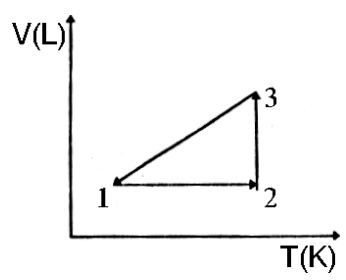
Analise-o. A opção em que aparece a correspondência das etapas numeradas (1 → 2 → 3 e 3 → 1), com suas respectivas denominações, é:
a) Isobárica, Adiabática e Isotérmica;
b) Isovolumétrica, Isotérmica e Isobárica;
c) Isovolumétrica, Isobárica e Isotérmica;
d) Isotérmica, Isobárica e Isovolumétrica;
e) Isovolumétrica, Isobárica e Adiabática.
3) Considerando a pressão de um gás ideal constante, o volume ocupado por ele é de 3 litros e a temperatura varia de 400 K para 800 K. Qual o volume final que este gás ocupa no frasco?
a) 3 l
b) 4 l
c) 5 l
d) 6 l
e) 7 l
4) Um gás ideal ocupa 5 litros em um recipiente, a pressão dentro do frasco é de 4 atm. Suponha que o gás sofra uma expansão isotérmica e passe a ocupar 8 litros. Qual será a pressão dentro do frasco?
a) 4 atm
b) 3 atm
c) 2,5 atm
d) 2 atm
e) 1,5 atm
5) Um frasco fechado contém um gás a 27°C, exercendo uma pressão de 3,0 atm. Se provocarmos uma elevação na sua temperatura até atingir 227°C, qual será a sua nova pressão, mantendo-se constante o volume?
a) 1,0 atm.
b) 2,0 atm.
c) 3,0 atm.
d) 4,0 atm.
e) 5,0 atm.
Nenhum comentário:
Postar um comentário
Não esqueça de colocar seu nome completo e série/ano turma