* Leiam com atenção e observem os exemplos.
* Assistam às aulas pelo CMSP, TV e plataforma Stoodi.
* Façam pesquisas em livros didáticos ou pela internet.
* Identifiquem as atividades com a data de postagem, nome, turma, série e nº de chamada (se possível).
* Enviem as atividades para o E-mail: josecorreia@prof.educacao.sp.gov.br
* Data de entrega: até 08/09.
Olá pessoal! que todos estejam bem.
Nessa semana vamos estudar o átomo de Bohr, que é muito importante para a compreensão da física quântica. Apesar de que o modelo atômico de Bohr só funcione para o átomo de Hidrogênio, pois tem apenas um elétron. Para átomos com mais de um elétron, esse modelo está completamente errado, mas explica muito bem a absorção e emissão de energia, pois quantizou as órbitas do elétron.
Quantizar significa que só pode ter valores inteiros de energia. Assim, pode-se compreender que os elétrons só podem ocupar órbitas permitidas, que dependem da absorção ou emissão de energia. Energia essa que é transmitida através de fótons (partículas de luz), ou por aquecimento (energia térmica).
Quando um elétron absorve energia ele passa para um estado excitado, e ao emitir energia volta para o estado fundamental emitindo energia na forma de luz.
Em 1911, o físico neozelandês Ernest Rutherford (1871-1937) realizou uma experiência com o objetivo de aprofundar os conhecimentos sobre o modelo atômico até então adotado, que era o de Thomson; no qual o átomo seria uma esfera de carga elétrica positiva, não maciça, incrustada de elétrons (negativos), de modo que sua carga elétrica total seria nula.
Para realizar tal experimento ele bombardeou uma finíssima folha-de-ouro (espessura de aproximadamente 10-4 mm), por um feixe de partículas alfa (α), vindo de uma amostra de polônio. Conforme o esquema abaixo, o polônio estava dentro de um bloco de chumbo, com um orifício, por onde apenas seria permitida a saída das emissões de partículas alfa.
Além disso, foram colocadas placas de chumbos com orifícios em seus centros, que orientariam o feixe na direção da lâmina de ouro. E, por fim, colocou-se atrás da lâmina um anteparo recoberto com sulfeto de zinco, que é uma substância fluorescente, onde era possível visualizar o caminho percorrido pelas partículas alfa.
Ao final deste experimento, Rutherford notou que a maioria das partículas alfa atravessava a lâmina, não desviava, nem retrocedia. Algumas partículas alfa se desviavam, e muito poucas retrocediam.
Baseando-se nestes dados, Rutherford concluiu que, ao contrário do que Dalton pensava o átomo não poderia ser maciço. Mas, na verdade, grande parte do átomo seria vazio e ele conteria um núcleo muito pequeno, denso e positivo, conforme a figura abaixo mostra.
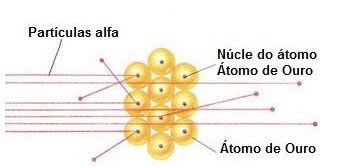
Em razão de o átomo ter sua maior parte vazia, a maioria das partículas não sofreu alteração no seu percurso.
Além disso, visto que as partículas alfa são positivas – da mesma forma que os núcleos dos átomos que compõem a lâmina de ouro – ao passarem próximas a estes núcleos, elas se desviavam. Estes núcleos seriam muito pequenos, por isso a incidência deste fato era menor. E quando as partículas alfa se chocavam diretamente com os núcleos dos átomos (incidência menor ainda), eles se repeliam e por isso poucas retrocediam.
Desse modo, Rutherford criou um modelo atômico que seria semelhante ao sistema planetário: o Sol seria o núcleo, e os planetas seriam os elétrons girando ao redor do núcleo.

Modelo de Rutherford para o átomo
No entanto, surge a pergunta: se carga de sinais iguais se repelem, como poderia o átomo permanecer estável se no núcleo só haviam partículas positivas, denominadas prótons?
Esta pergunta obteve uma resposta satisfatória quando, em 1932, houve a descoberta da terceira partícula subatômica: o nêutron (partícula sem carga elétrica que ficaria no núcleo, isolando os prótons uns dos outros, evitando que houvesse possíveis repulsões e que o núcleo desmoronasse).
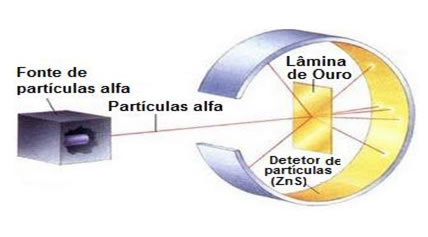
Esquema do experimento de Rutherford com partículas alfa
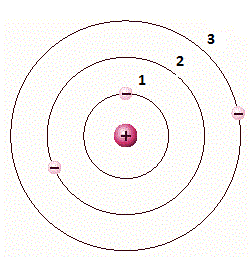
Em um átomo, os elétrons encontram-se em diferentes níveis de energia. Os elétrons dos níveis de mais baixa energia estão mais próximos do núcleo; já os que estão em níveis de mais alta energia, situam-se mais distantes do núcleo.
A figura abaixo apresenta um átomo cujos elétrons estão em diferentes níveis de energia. Para que o elétron do nível 1 passe para o nível 2, precisamos fornecer certa energia a ele, já que o núcleo exerce uma força de atração sobre esse elétron.
Desse modo, no nível 2, o elétron encontra-se em um nível de energia maior do que quando ocupava o nível 1.
O átomo sempre foi estudado por meio de modelos propostos pelos cientistas. Cada modelo trouxe hipóteses baseadas em formulações teóricas e nos resultados experimentais obtidos pelos seus respectivos autores, permanecendo válido até que apresentasse falhas na explicação dos fenômenos. Caso isso ocorresse, os pesquisadores deveriam propor novos modelos ou adaptações às teorias já desenvolvidas.
Em 1911, Ernest Rutherford propôs um modelo que descrevia o átomo como um sistema planetário, no qual havia um núcleo central com carga positiva e elétrons em órbita ao redor. Embora importante, o modelo de Rutherford não explicava corretamente alguns fenômenos. De acordo com a teoria proposta por Maxwell, qualquer carga dotada de aceleração deveria emitir radiação eletromagnética, perdendo energia. Visto que um elétron do átomo de Rutherford descrevia uma órbita circular e, portanto, possuía aceleração centrípeta, ele deveria emitir permanentemente radiação, reduzindo seu nível de energia. Desse modo, deveria descrever uma trajetória espiralada até cair no núcleo, o que não ocorria, uma vez que as eletrosferas dos átomos são estáveis.
Além disso, há outro problema no modelo de Rutherford. Segundo Maxwell, a radiação emitida pelo elétron tem a mesma frequência do movimento. Assim, como a frequência do movimento do elétron deveria variar continuamente na ida até o núcleo, o elétron também deveria emitir continuamente radiação com frequência variável. Porém, a radiação emitida por um átomo deve ter apenas frequências de determinados valores, diferentemente da radiação térmica emitida por um corpo, a qual apresenta um espectro contínuo.
Em virtude desas incoerências, Niels Bohr desenvolveu uma nova teoria, baseada em ideias quânticas. Bohr inferiu que, para a eletrosfera de um átomo ser mantida estável, os elétrons desse átomo deveriam assumir certos níveis de energia, chamados estados estacionários ou quânticos, cada um deles correspondendo a uma determinada energia. Ele postulou que, em um estado estacionário, o átomo não emitia radiação, de modo que sua eletrosfera se mantinha estável.
Gustav Hertz e James Franck, no ano seguinte, confirmaram a existência dos estados estacionários. O estado estacionário, cujos elétrons estão nos mais baixos níveis de energia, é chamado de estado fundamental; os demais estados permitidos são chamados de estados excitados. Isso quer dizer que são permitidos apenas o estado fundamental e os demais estados excitados — quaisquer outros estados são proibidos.
Considerando o caso particular do hidrogênio, que é constituído por apenas um elétron, os níves de energia podem ser obtidos pela expressão abaixo:
Onde o número quântico principal é simbolizado pela letra n (= 1, 2, 3...) e En é a energia correspondente a cada número quântico.
É importante ressaltar que n = 1 corresponde ao estado fundamental de energia. Além disso, os valores de energia são negativos, o que significa que o elétron precisa receber energia para chegar ao nível, deixando de interagir com o núcleo nesse momento, ou perdendo o vínculo com o átomo.
Bohr também postulou que todo átomo, ao passar de um estado estacionário para outro, emite ou absorve um quantum de energia exatamente igual à diferença entre as energias correspondentes a esses estados. Esse resultado não pode ser explicado pela teoria eletromagnética clássica, uma vez que, de acordo com ela, a frequência da radiação emitida está relacionada com a frequência do movimento do elétron. Hoje sabemos que isso não está correto, visto que a frequência da radiação emitida relaciona-se apenas com a diferença de energia entre os estados inicial e final.
Segundo Bohr, os elétrons descrevem trajetórias circulares ao redor de um núcleo positivo devido à força de atração dada pela Lei de Coulomb que, nesse caso, é a força centrípeta do movimento. Os raios dessas trajetórias só podem assumir certos valores bem determinados. Para o hidrogênio, por exemplo, os valores permitidos para os raios são dados pela expressão abaixo:
Onde:
n = número quântico (n = 1, 2, 3...);
rn = raio da órbita correspondente ao número quântico n;
r1 = raio correspondente ao estado fundamental de energia, dado por:
Onde:
h = constante de Planck (h = 6,63x10-34J s);
K = constante eletrostática do vácuo (K = 9x109 Nm²/C²);
Z = número atômico do elemento químico;
e = carga do elétron (K = 1,6x10-19 C);
m = massa do elétron (e = 9,1 x10-31 kg).
A unidade de medida de energia, na Física quântica, é o elétron-volt (eV).
1 eV = 1,6 . 10-¹⁹ J
Uma das aplicações da física quântica é a espectroscopia. Todos os elementos químicos, quando no estado de vapor, emitem radiação eletromagnética em determinadas frequências, as quais emitem luz. Através da cor da luz emitida é possível saber qual é o elemento químico que constitui tal substância.
Uma das aplicações da física quântica é a espectroscopia. Todos os elementos químicos, quando no estado de vapor, emitem radiação eletromagnética em determinadas frequências, as quais emitem luz. Através da cor da luz emitida é possível saber qual é o elemento químico que constitui tal substância.
A espectroscopia é uma técnica experimental que se baseia na utilização da luz para estudar a composição, a estrutura e as propriedades da matéria. A raiz da palavra, do latim spectrum (imagem, aparição), remete para algo como “observação da imagem oculta”. Embora historicamente tenha origem na observação da luz visível dispersa por um prisma, o conceito atual abarca qualquer descrição da interação radiação-matéria em função da energia da radiação.
Numa experiência de espectroscopia, a amostra a estudar é irradiada com o feixe de luz incidente e a análise é feita à luz transmitida, emitida ou difundida pela amostra (FIGURA 1). O resultado obtido é um registo que compara a composição da luz incidente na amostra com a luz transmitida, emitida ou difundida, e é designado por “espectro” da amostra. O registo de um espectro é efetuado através de equipamentos experimentais designados por espectrómetro, espectrofotómetro e espectrógrafo.
Para entender o fenómeno de interação radiação-matéria que está na base da espectroscopia, são necessários dois conceitos, relacionados com as propriedades da luz e com a natureza quântica da matéria:
- A luz, ou radiação eletromagnética, tem energia diferente consoante a sua frequência (ou consoante o seu comprimento de onda, que varia inversamente à frequência). Por exemplo, na região do visível, a energia da radiação aumenta ao longo das cores do arco-íris, do vermelho até ao violeta. A radiação infravermelha tem menor energia que o vermelho, e a luz ultravioleta tem energia superior ao violeta (energia suficiente para danificar a pele, daí a necessidade de protetores solares para ultravioleta).
- Os sistemas atómico-moleculares que constituem a matéria apresentam estados de energia discretos, que podem ser vistos como os degraus de uma escada: cada degrau é um nível de energia e é possível subir/descer de nível recebendo/libertando a energia correspondente à altura do degrau, mas não é possível estar a meio caminho, entre degraus. Se os níveis de energia fossem contínuos, a analogia seria com uma rampa, na qual é possível parar em qualquer local. Dependendo da natureza e composição da amostra, os “degraus” apresentam diferentes alturas, ou seja, sistemas atómico-moleculares diferentes apresentam níveis de energia com separações diferentes. E conhecer a separação entre os níveis de energia permite compreender a estrutura e as propriedades de uma dada amostra.
Assim, a espectroscopia utiliza a luz para medir a diferença de energia entre os níveis energéticos de um sistema. Isto pode ser feito de três formas (FIGURA 2): por absorção de radiação com a energia exata entre níveis (a), por emissão de radiação com essa mesma energia (b), ou por difusão inelástica (c) – neste caso, a diferença entre níveis é medida pela diferença de energia entre a luz incidente e a luz difundida.
A FIGURA 3 ilustra esquematicamente um espectro de absorção, na sua representação original e na representação gráfica mais comum.
A abordagem mais rigorosa da interação radiação-matéria exige o aprofundamento dos dois conceitos fundamentais acima referidos. Relativamente à composição e propriedades da luz, esta pode ser descrita pelas propriedades de radiação eletromagnética (oscilação de um campo elétrico e de um campo magnético, com determinada frequência e comprimento de onda) ou pelo comportamento de partícula de energia, designada por fotão. Também no que respeita aos níveis de energia de um sistema atómico-molecular, é necessário saber que estão associados a rotações moleculares, a vibração dos átomos em torno das posições de equilíbrio e à distribuição dos eletrões pelas orbitais moleculares. Cada nível é descrito por uma função de onda, e a intensidade da interação radiação-matéria é proporcional ao integral que relaciona as funções de onda do estado inicial e final com o operador de transição.
As transições de energia dos elétrons de cada elemento são únicas e diferentes umas das outras. Portanto, analisando as cores de luz emitidas por um determinado átomo, podemos identificar tal elemento com base em seu espectro de emissão. A imagem abaixo mostra alguns exemplos de espectros de emissão de alguns elementos comuns:
Como cada espectro de emissão é único para o elemento, podemos entendê-los como a "impressão digital" de cada elemento. As faixas indicam os comprimentos de onda de luz específicos emitidos quando os elétrons de cada elemento saem do estado excitado para um estado energético mais baixo. Os cientistas conseguem isolar esses diferentes comprimentos de onda incidindo a luz de átomos excitados por um prisma, que separa os diferentes comprimentos de onda por meio do processo de refração. Mas, sem um prisma, não vemos esses diferentes comprimentos de onda de luz separadamente, mas sim todos misturados. Ainda assim, a cor emitida por cada elemento é bastante distinta, o que costuma ser útil em um laboratório.
Exemplos.
1) Para que um elétron, no átomo de Bohr, salte do nível fundamental para o terceiro nível energético, será necessário que ele absorva que quantidade de energia?
Resolução:
Sabemos que para o átomo de Bohr a energia é quantizada, e que é calculada por:
E = En₃ - En₁
E = -13,6 - (-13,6)
n²₃ n²₁
E = -13,6 + 13,6
3² 1²
E = -13,6 + 13,6
9 1
E = -1,511 + 13,6
E = 12,09 eV
2) (Adaptado) O elétron do átomo de hidrogênio, ao passar do primeiro estado estacionário excitado, n=2, para o estado fundamental, n=1,emite um fóton.
 Para responder a essa questão temos que determinar o comprimento de onda do fóton emitido.
Para responder a essa questão temos que determinar o comprimento de onda do fóton emitido.
E = En₂ - En₁
E = -13,6/2² - (-13,6/1²)
E = -13,6/4 + 13,6/1
E = -3,4 + 13,6
E = 10,2 eV
Com a energia vamos calcular a frequência. Sabendo que a constante de Planck é h = 4,1.10-15 eV.s
E = h . f
10,2 = 4,1.10-15 . f
10,2/4,1.10-¹⁵ = f
f = 2,48 . 10¹⁵ Hz
Agora conseguimos determinar o comprimento de onda através da fórmula da velocidade de propagação das ondas.
c = λ . f
3 .10⁸ = λ . 2,48 .10¹⁵
3 .10⁸/2,48 .10¹⁵ = λ
λ = 1,2 . 10-⁷ m
De acordo com a figura, temos que a resposta é a radiação ultravioleta.
Resposta: C
Exemplos.
1) Para que um elétron, no átomo de Bohr, salte do nível fundamental para o terceiro nível energético, será necessário que ele absorva que quantidade de energia?
Resolução:
Sabemos que para o átomo de Bohr a energia é quantizada, e que é calculada por:
E = En₃ - En₁
E = -13,6 - (-13,6)
n²₃ n²₁
E = -13,6 + 13,6
3² 1²
E = -13,6 + 13,6
9 1
E = -1,511 + 13,6
E = 12,09 eV
2) (Adaptado) O elétron do átomo de hidrogênio, ao passar do primeiro estado estacionário excitado, n=2, para o estado fundamental, n=1,emite um fóton.
Tendo em vista o diagrama da figura abaixo, que apresenta, de maneira aproximada, os comprimentos de onda das diversas radiações, componentes do espectro eletromagnético, pode-se concluir que o comprimento de onda desse fóton emitido corresponde a uma radiação na região do(s)

Dados:
Constante de Planck h = 4,1.10-15 eV.s
Velocidade da luz c = 3.108m/s
Constante de Planck h = 4,1.10-15 eV.s
Velocidade da luz c = 3.108m/s
E = En₂ - En₁
E = -13,6/2² - (-13,6/1²)
E = -13,6/4 + 13,6/1
E = -3,4 + 13,6
E = 10,2 eV
Com a energia vamos calcular a frequência. Sabendo que a constante de Planck é h = 4,1.10-15 eV.s
E = h . f
10,2 = 4,1.10-15 . f
10,2/4,1.10-¹⁵ = f
f = 2,48 . 10¹⁵ Hz
Agora conseguimos determinar o comprimento de onda através da fórmula da velocidade de propagação das ondas.
c = λ . f
3 .10⁸ = λ . 2,48 .10¹⁵
3 .10⁸/2,48 .10¹⁵ = λ
λ = 1,2 . 10-⁷ m
De acordo com a figura, temos que a resposta é a radiação ultravioleta.
Resposta: C
Exercícios.
1) Uma moda atual entre as crianças é colecionar figurinhas que brilham no escuro. Essas figuras apresentam em sua constituição a substância sulfeto de zinco. O fenômeno ocorre porque alguns elétrons que compõem os átomos dessa substância absorvem energia luminosa e saltam para níveis de energia mais externos. No escuro, esses elétrons retornam aos seus níveis originais, liberando energia luminosa e fazendo a figurinha brilhar. Essa característica pode ser explicada considerando-se o modelo atômico proposto por:
a) Dalton.
b) Thomson.
c) Bohr.
d) Rutherford.
e) Lavoisier.
2) Considere as seguintes afirmações referentes aos postulados elaborados por Bohr ao conceber o seu modelo atômico:
I. Em um átomo são permitidas somente algumas órbitas circulares ao elétron;
II. Cada uma dessas órbitas apresenta energia variável;
III. Um elétron só pode assumir determinados valores de energia, que correspondem às órbitas permitidas, tendo, assim, determinados níveis de energia ou camadas energéticas;
IV. Um elétron pode absorver energia de uma fonte externa somente em unidades discretas, chamadas de quanta ou quantum no singular.
Indique a alternativa correta:
a) todas estão corretas.
b) somente I, III e IV estão corretas.
c) somente II e III estão corretas.
d) somente I, II e IV estão corretas.
e) somente I e IV estão corretas.
3) Para se produzirem fogos de artifício de diferentes cores, misturam-se diferentes compostos químicos à pólvora. Os compostos à base de sódio produzem luz amarela e os à base de bário, luz verde. Sabe-se que a frequência da luz amarela é menor que a da verde. Sejam ENa e EBa as diferenças de energia entre os níveis de energia envolvidos na emissão de luz pelos átomos de sódio e de bário, respectivamente, e vNa e vBa as velocidades dos fótons emitidos, também respectivamente. Assim sendo, é CORRETO afirmar que:
4) A energia que um elétron, em um átomo de hidrogênio, possui, em seu enésimo estado (nível de energia = n), é dada por onde eV(elétron-volt) é uma unidade de medida de energia muito utilizada em Física Moderna, para que os cálculos sejam facilitados. Um átomo de hidrogênio possui um elétron que é excitado, a partir do estado fundamental, para o seu terceiro estado excitado. A energia que deve ser fornecida para este elétron, para que esse processo ocorra, deve ser de
onde eV(elétron-volt) é uma unidade de medida de energia muito utilizada em Física Moderna, para que os cálculos sejam facilitados. Um átomo de hidrogênio possui um elétron que é excitado, a partir do estado fundamental, para o seu terceiro estado excitado. A energia que deve ser fornecida para este elétron, para que esse processo ocorra, deve ser de
 onde eV(elétron-volt) é uma unidade de medida de energia muito utilizada em Física Moderna, para que os cálculos sejam facilitados. Um átomo de hidrogênio possui um elétron que é excitado, a partir do estado fundamental, para o seu terceiro estado excitado. A energia que deve ser fornecida para este elétron, para que esse processo ocorra, deve ser de
onde eV(elétron-volt) é uma unidade de medida de energia muito utilizada em Física Moderna, para que os cálculos sejam facilitados. Um átomo de hidrogênio possui um elétron que é excitado, a partir do estado fundamental, para o seu terceiro estado excitado. A energia que deve ser fornecida para este elétron, para que esse processo ocorra, deve ser de
5) Escolha, dentre as alternativas, aquela que fornece as palavras corretas para preencher as lacunas vazias do enunciado relacionado ao modelo atômico estabelecido por Böhr.
Quando um elétron absorve certa quantidade de ................., salta para uma órbita mais ....................... Quando ele retorna à sua órbita original, .................... a mesma quantidade de energia, na forma de ........................

Nenhum comentário:
Postar um comentário
Não esqueça de colocar seu nome completo e série/ano turma